- Hintergrund
-
Ergebnisse
- Ergebnis 1: Die nicht-klinische Zusammenfassung von Moderna enthält größtenteils irrelevante Materialien und drei verschiedene Versionen des Moduls 2.4.
- Ergebnis 2: Moderna behauptet, dass die Wirkstoff-mRNAs von SPIKEVAX nicht auf Toxizität untersucht werden müssen und ohne weitere Tests durch jede andere mRNA ersetzt werden können.
- Ergebnis 3: Das nichtklinische Programm von Moderna bestand aus Studien mit irrelevanten, nicht zugelassenen mRNAs und umfasste nur eine toxikologische Studie zu mRNA-1273 (Wirkstoff von SPIKEVAX).
- Ergebnis 4: Es gibt zwei verschiedene Zulassungsnummern für mRNA-1273: eine wird von Moderna, die andere von DMID (NIH) gehalten, was einen schwerwiegenden Interessenkonflikt darstellt.
- Ergebnis 5: Eine durch den Impfstoff ausgelöste, durch Antikörper verstärkte Krankheit wurde als ernstes Risiko eingestuft und von Moderna nicht ausgeschlossen, da es keine Positivkontrolle gab und nicht validierte Forschungsmethoden angewandt wurden.
- Ergebnis 6: FDA und Moderna haben in öffentlichen Bekanntmachungen und bei der Produktkennzeichnung über reproduktionstoxikologische Studien gelogen.
- Welche nichtklinischen Sicherheitsdaten hat die FDA letztendlich für die Zulassungsentscheidung verwendet?
Von Sasha Latypova / Trial Site News
![]()
Hintergrund
In meinem letzten Artikel habe ich die Zusammenfassung der nicht-klinischen Tests zu BNT162 von Pfizer besprochen,1 die durch eine erfolgreiche Klage auf Informationsfreiheit von Judicial Watch erlangt wurde.2 Kürzlich ist eine analoge Zusammenstellung von Materialien für SPIKEVAX von Moderna verfügbar geworden. Nichtklinische Tests sind Teil des Entwicklungsprozesses von Medikamenten oder Impfstoffen, bei dem das Produkt an Zelllinien und Tieren getestet wird. Die vor 2020 verfügbaren FDA-Leitliniendokumente für gentherapeutische Plattformen stammen aus den Jahren 2013 (nichtklinische Leitlinie3 ) und 2015 (klinische Leitlinie4 ), doch veröffentlicht die FDA bereits seit 1998 Leitlinien für Zell- und Gentherapien5. Daher liegt seit mehr als 20 Jahren ein umfangreicher Bestand an regulatorischem Wissen über nichtklinische und klinische Testanforderungen für diese Produktklasse vor. In diesen Unterlagen wurden viele ernsthafte Risiken dokumentiert; darunter Tod, potenzielle Krebsentstehung, unkontrollierbare Expression von Proteinen, Erbgutschädigung, Fortpflanzungsschäden, potenzielle Übertragung durch “Shedding” und vieles mehr. Sowohl von den Herstellern als auch von den Aufsichtsbehörden wurde erwartet, dass sie diese Risiken erkennen und Testprogramme entwickeln, um sie auszuschließen oder vollständig zu charakterisieren.
![]()
Das vom HHS erhaltene Unterlagenpaket enthielt 699 Seiten mit Studien und Testergebnissen, die angeblich von der FDA zur Freigabe der auf der mRNA-Technologie basierenden mRNA-1273 (Modernas Corona-Impfstoff oder SPIKEVAX) verwendet wurden.
![]()
Ich kommentiere in erster Linie den Umfang und die regulatorische Vollständigkeit des Pakets, da die vollständigen Berichte über die Studien selbst immer noch nicht verfügbar und/oder für das Produkt irrelevant sind, wie weiter unten erläutert wird.
![]()
Ergebnisse
- Die Zusammenfassung der nichtklinischen Studien von Moderna enthält größtenteils irrelevantes Material.
- Moderna behauptet, dass die Wirkstoff-mRNAs von Spikevax nicht auf Toxizität untersucht werden müssen und ohne weitere Tests durch jede andere mRNA ersetzt werden können.
- Das nichtklinische Programm von Moderna bestand aus Studien mit anderen nicht zugelassenen mRNAs und nur einer nicht der Guten Laborpraxis (GLP) entsprechenden Toxikologiestudie mit mRNA-1273 (aktiver Wirkstoff von SPIKEVAX).
- Es gibt zwei getrennte Zulassungsnummern für mRNA-1273: eine wird von Moderna, die andere von DMID (NIH) gehalten, was einen ernsthaften Interessenkonflikt darstellt.
- Die durch den Impfstoff ausgelöste und durch Antikörper verstärkte Krankheit wurde als ernsthaftes Risiko erkannt und von Moderna nicht ausgeschlossen, da es keine Positivkontrolle gab und nicht validierte Methoden verwendet wurden.
- Die FDA und Moderna haben bezüglich der Studien zur Reproduktionstoxikologie in öffentlichen Bekanntmachungen und bei der Produktkennzeichnung gelogen.
Ergebnis 1: Die nicht-klinische Zusammenfassung von Moderna enthält größtenteils irrelevante Materialien und drei verschiedene Versionen des Moduls 2.4.
Das nichtklinische Unterlagenpaket ist zwar 699 Seiten lang, enthält aber größtenteils irrelevante Materialien. Etwa 80% der in dem Paket enthaltenen Materialien beziehen sich auf andere mRNA-Produkte, die nichts mit Sars-Cov-2 oder Covid zu tun haben. Das gesamte Paket ist chaotisch geordnet, möglicherweise absichtlich, um das Lesen und Interpretieren zu erschweren. Etwa 400 Seiten des Materials gehören zu einer Biodistributionsstudie an Ratten, die in der Charles-River-Anlage in Kanada für das irrelevante Testprodukt mRNA-1674 durchgeführt wurde. Bei diesem Produkt handelt es sich um ein Konstrukt aus 6 verschiedenen mRNAs, das 2017 auf Cytomegalie-Viren untersucht und nie für den Markt zugelassen wurde. Diese Studie zeigte die Verteilung der Lipid-Nanopartikel im gesamten Körper und in allen wichtigen Organsystemen (siehe Ergebnis 2). Das Studienprotokoll, der Bericht und die Änderungsanträge wurden mehrfach kopiert und aus unerfindlichem Grund sowohl am Anfang als auch am Ende des HHS-Pakets eingefügt. Wurde versucht, eine Mindestwortzahl einzuhalten?
![]()
Zwischen den zahlreichen Kopien derselben irrelevanten Studie fand ich “ModernaTX, Inc. 2.4 Nonclinical Overview” für mRNA-1273 mit der Referenz IND#19745 für den Antrag auf Zulassung eines neuen Arzneimittels. Modul 2.4 ist ein Standardbestandteil des Antrags auf Zulassung eines neuen Arzneimittels und soll die Zusammenfassungen der nichtklinischen Studien enthalten.
![]()
Es sind drei verschiedene Versionen von Modul 2.4 enthalten und viele Abschnitte scheinen zu fehlen. Es ist nicht klar, warum mehrere Versionen enthalten sind, und es wird nicht erläutert, welche Version speziell für die Zulassung von SPIKEVAX durch die FDA verwendet wurde. Modul 2.4 beginnt auf Seite FDA-CBER-2021-4379-0001130 und endet auf Seite -0001160, die zweite und dritte Kopie beginnt auf Seite 0001462 und endet auf Seite -0001548. Im Folgenden beziehe ich mich auf die letzte Ziffernfolge der Seitenmarke. Bei den drei Exemplaren von Modul 2.4 scheint es sich um eine ähnliche Version desselben Übersichtsdokuments zu handeln; sie enthalten jedoch unterschiedliche Aussagen und Studien, auf die Bezug genommen wird.
![]()
Die Beschreibung des gelieferten Endprodukts unterscheidet sich zwischen den beiden Versionen (Unterschiede in rot):
![]()
- Version 1 (S. -0001466): “mRNA-1273 wird als sterile Flüssigkeit zur Injektion in einer Konzentration von 5 mg/mL in 20 mM Trometamol (Tris)-Puffer mit 87 mg/mL Saccharose und 10,7 mM Natriumacetat bei einem pH-Wert von 7,5 bereitgestellt.”
- Version 2 (S. -0001499): “Das mRNA-1273-Arzneimittel wird als sterile Suspension zur Injektion in einer Konzentration von 20 mg/ml in 20 mM Tris-Puffer mit 87 g/L Saccharose und 4,3 mM Acetat bei einem pH-Wert von 7,5 bereitgestellt.”
Aus Abschnitt 2.4.1.2 Testmaterial (S.-0001499) geht hervor, dass die Version 2 des Arzneimittels für die Herstellung der Charge AMPDP-200005 verwendet wurde, die für nichtklinische Studien eingesetzt wurde. Es wird keine Erklärung dafür gegeben, warum das Arzneimittel in Version 1 unterschiedlich ist und es werden keine Studien zur Vergleichbarkeit der beiden Produktspezifikationen vorgelegt. Seltsamerweise enthält die zugelassene Etikettierung von Modernas SPIKEVAX keine Informationen über die Konzentration des in den Fläschchen enthaltenen Produkts6.
![]()
Schließlich sind alle Dokumente mangelhaft und oft inkompetent verfasst. Es gibt zahlreiche hypothetische Aussagen, die durch keinerlei Daten gestützt werden, sowie Theorien und Eingeständnisse, dass nicht validierte Tests verwendet wurden, und sich wiederholende Absätze. Es ist schockierend, dass dies die gesamte toxikologische Sicherheitsbewertung für ein völlig neuartiges Produkt darstellt, das weltweit in Millionen von Armen injiziert wurde.
![]()
Ergebnis 2: Moderna behauptet, dass die Wirkstoff-mRNAs von SPIKEVAX nicht auf Toxizität untersucht werden müssen und ohne weitere Tests durch jede andere mRNA ersetzt werden können.
Die Täuschung, die Moderna (und Pfizer und Janssen) – wahrscheinlich mit völliger Komplizenschaft der FDA – begangen hat, liegt in ihrer Behauptung, dass alle Produktrisiken mit der Plattform für die Verabreichung von Lipid-Nanopartikeln (LNP) verbunden sind und die mRNA-“Nutzlast” nicht durch standardmäßige toxikologische Sicherheitstests untersucht werden muss. Auf S. – 0001499 heißt es:
![]()
“Die Distribution, Toxizität und Genotoxizität im Zusammenhang mit mRNA-Impfstoffen, die in LNPs formuliert sind, werden in erster Linie durch die Zusammensetzung der LNPs und in geringerem Maße durch die biologische Aktivität des von der mRNA kodierten Antigens bestimmt. Daher werden die Distributionsstudie, die der Guten Laborpraxis (GLP) entsprechenden Toxikologiestudien und die In-vivo-GLP-konforme Genotoxizitätsstudie, die mit mRNA-Impfstoffen durchgeführt wurden, die für verschiedene Antigene kodieren und mit der mRNA-basierten Plattform des Auftraggebers unter Verwendung von SM102-haltigen LNPs entwickelt wurden, als unterstützend betrachtet und ermöglichen die Beantragung einer biologischen Zulassung für mRNA-1273.”
Das Unternehmen behauptet, dass der Wirkstoff eines neuen Medikaments nicht auf Toxizität getestet werden muss. Dies ist vergleichbar mit der Behauptung, dass ein mit Lebensmitteln beladener Lastwagen und ein mit Sprengstoff beladener Lastwagen dasselbe sind. Ignorieren Sie die Ladung, konzentrieren Sie sich auf das Fahrzeug. Die Behauptung ist absurd – die mRNAs und LNPs sind sowohl einzeln als auch zusammen völlig neuartige chemische Einheiten, für die jeweils ein eigener IND-Antrag (Investigational New Drug) und ein eigenes Datendossier bei den Regulierungsbehörden eingereicht werden müssen. Studien mit einer mRNA sind kein Ersatz für alle anderen.
![]()
Für das mRNA-Produkt von Pfizer beispielsweise haben die Gutachter der Europäischen Arzneimittelagentur (EMA) folgende Stellungnahme abgegeben:
![]()
“Die modifizierte mRNA im COVID-19 mRNA-Impfstoff ist ein chemischer Wirkstoff, der bisher in der Europäischen Union noch nicht als Arzneimittel zugelassen war (sic). Von der chemischen Struktur her ist die modifizierte mRNA mit keinem anderen zugelassenen Stoff verwandt. Sie ist nicht strukturell verwandt mit Salz, Ester, Ether, Isomer, Isomerengemisch, Komplex oder Derivat eines bereits in der Europäischen Union zugelassenen Wirkstoffs.
Die modifizierte mRNA ist kein aktives Metabolit eines in der Europäischen Union zugelassenen Wirkstoffs/von in der Europäischen Union zugelassenen Wirkstoffen. Die modifizierte mRNA ist keine Vorstufe (Pro-Drug) eines bereits zugelassenen Wirkstoffs. Durch die Verabreichung des angewandten Wirkstoffs werden die Patienten nicht demselben therapeutischen Anteil ausgesetzt wie bei einem bereits in der Europäischen Union zugelassenen Wirkstoff.
In Übereinstimmung mit dem ‘Reflexionspapier über die Kriterien für die chemische Struktur und die Eigenschaften, die bei der Bewertung des Status eines neuen Wirkstoffs (NAS) von chemischen Stoffen zu berücksichtigen sind’ (EMA/CHMP/QWP/104223/2015) wird COVID-19 mRNA Vaccine daher als neuer Wirkstoff eingestuft und als neu an sich betrachtet.”7
Mit anderen Worten: Dieser chemische Wirkstoff ist VÖLLIG NEUARTIG. Nichts Vergleichbares wurde bisher für den Markt zugelassen. Die Gutachter stellten ausdrücklich fest, dass die “modifizierte RNA” und nicht nur die Lipidhülle den neuen chemischen Wirkstoff darstellt. Alle neuen chemischen Substanzen müssen strenge Sicherheitstests durchlaufen, bevor sie in den Vereinigten Staaten, der Europäischen Union und dem Rest der Welt als Arzneimittel zugelassen werden.
![]()
Darüber hinaus wird die Behauptung des Herstellers durch keinerlei reale Daten gestützt; es werden keine Studien zitiert, die belegen, dass die gesamte Toxizität des Produkts auf die Lipidhülle und nicht auf die “Nutzlast”, d. h. die Art und Sequenz der an verschiedene Gewebe und Organe abgegebenen mRNA, zurückzuführen ist. Außerdem werden einige Bestandteile der Lipidhülle, wie Cholesterin und DSPC, in einem völlig neuartigen zweiteiligen Konstrukt verwendet, auch wenn sie nicht als neuartige chemische Einheiten betrachtet werden können.
![]()
Es handelt sich auch nicht um einen Fehler oder eine überstürzte Markteinführung einer neuen Technologie unter “Krisenbedingungen”. Diese wissenschaftlich betrügerische Strategie war nicht nur vorsätzlich, sondern wurde auch nie wirklich verheimlicht. In einer Powerpoint-Präsentation auf einer JP Morgan-Konferenz im Jahr 2018, die mit datenlosen Zeichnungen und großspurigen Erklärungen gefüllt war, gab der CEO von Moderna Stephane Bencel beispielsweise die folgende Erklärung ab:
![]()
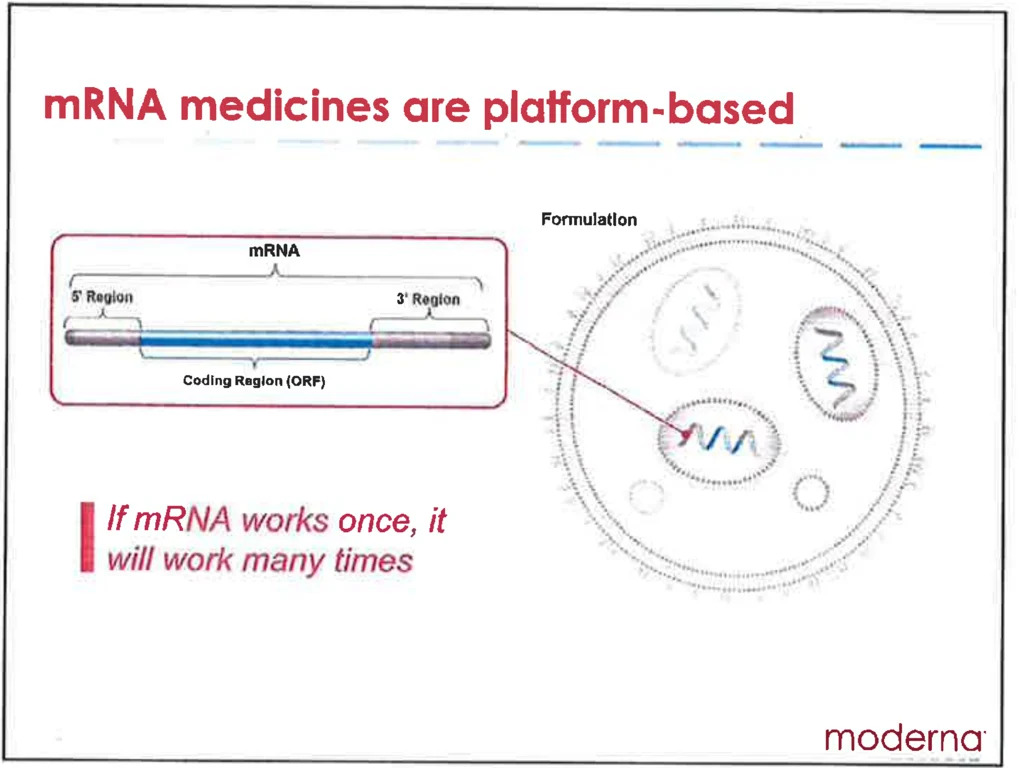
“Wenn mRNA einmal funktioniert, dann funktioniert sie viele Male” – so lässt sich der Betrug beschreiben, der von den Herstellern, der FDA, der CDC, den NIH, jeder staatlichen Gesundheitsbehörde und den Mainstream-Medien, die sich daran beteiligt haben, betrieben wird.
![]()
Stellen Sie sich vor, die Ford Motor Company behauptet, dass ihr Crashtestprogramm auf die Reifen des Fahrzeugs beschränkt sein sollte und dass ein Test für alle Fahrzeugmodelle ausreichend ist. Schließlich haben sowohl der F150 als auch der Taurus Reifen, und das, was zwischen den Reifen ist, “hat einmal funktioniert und wird wieder funktionieren”, und deshalb ist es für die Sicherheit unerheblich, muss nicht gesondert getestet werden und kann nach Belieben des Herstellers durch eine neue Variante ersetzt werden. Dies ist die Behauptung, die Moderna, Pfizer, Janssen und andere Hersteller von Gentherapie-“Plattformen” aufgestellt haben. Im Gegensatz zu den Produkten von Ford haben ihre Produkte NIEMALS FUNKTIONIERT, da keines ihrer mRNA-basierten Gentherapieprodukte jemals für irgendeine Indikation zugelassen worden ist. Die Tatsache, dass die Aufsichtsbehörden keine Einwände gegen dieses Argument erhoben haben, ist umso alarmierender. Von Inkompetenz oder Irrtum kann hier keine Rede sein. Wenn dies der derzeitige “Goldstandard” der pharmazeutischen Wissenschaft ist, habe ich sehr schlechte Nachrichten, was die Sicherheit der gesamten Versorgung mit neuen Medikamenten in den USA und der Welt angeht.
![]()
Ergebnis 3: Das nichtklinische Programm von Moderna bestand aus Studien mit irrelevanten, nicht zugelassenen mRNAs und umfasste nur eine toxikologische Studie zu mRNA-1273 (Wirkstoff von SPIKEVAX).
Ein typisches nichtklinisches Programm für ein neuartiges Produkt könnte Folgendes umfassen:
![]()
- Pharmakologie: Studien über die primäre und sekundäre Wirkungsweise. Im Falle von Behauptungen zur Krankheitsvorbeugung würde dies die erwünschte Immunogenität sowie den Nachweis des Fehlens unerwünschter Autoimmunität und Krankheitsverstärkung umfassen.
- Pharmakokinetik: Wie sich das Arzneimittel im Körper verteilt, mit Konzentrationen in den wichtigsten Organgruppen sowie einem charakteristischen Zeitverlauf der Biodistribution.
- Sicherheitspharmakologie und -toxikologie: Toxizitäten im Zusammenhang mit dem Arzneimittel für wichtige Organe oder Gewebe müssen ausgeschlossen und/oder gut charakterisiert werden.
- Andere toxikologische Studien wie Karzinogenität, Genotoxizität, Wechselwirkungen mit Arzneimitteln, Reproduktionstoxikologie, spezifische Populationstoxizitäten, usw.
Je neuartiger das Produkt ist, desto umfangreichere Sicherheits-/Toxizitätsbewertungen sind erforderlich.
![]()
Unter den drei verschiedenen Versionen von Modul 2.4 konnte ich etwa 29 einzigartige Studien identifizieren. Nur 10 davon wurden mit dem richtigen Prüfgegenstand (mRNA-1273) durchgeführt: 9 pharmakologische Studien (“Wirksamkeit”) und nur eine toxikologische Studie (“Sicherheit”). Bei all diesen Studien handelte es sich um Nicht-GLP-Studien, d. h. um Forschungsexperimente, die ohne zulassungsfähige Validierungsstandards durchgeführt wurden. Die anderen 20 Studien, darunter alle Pharmakokinetik- und fast alle Toxikologiestudien, wurden mit falschen Testartikeln durchgeführt (eine Vielzahl von nicht zugelassenen experimentellen mRNAs, die nichts mit SPIKEVAX oder Covid zu tun haben). Es gab nur 4 In-vitro- und 2 In-vivo-Genotoxizitätsstudien für das Lipid SM-102 und PEG2000DMG. Die In-vivo-Genotoxizitätsstudien umfassten eine irrelevante mRNA-1706 und eine Luziferase-mRNA. Die an Ratten durchgeführte Bewertung der Reproduktionstoxikologie wird weiter unten erörtert (Ergebnis 6).
![]()
Die Pharmakokinetik (Biodistribution) wurde nicht mit der mRNA-1273 von SPIKEVAX untersucht. Stattdessen schloss Moderna eine Reihe von Studien mit einer anderen, nicht verwandten mRNA-1647 ein, einem Konstrukt aus sechs verschiedenen mRNAs, das 2017 in einer nicht GLP-konformen Studie zur Behandlung des Zytomegalievirus [gehört zu den Herpesviren] entwickelt wurde. Dieses Produkt wurde nicht für den Markt zugelassen und sein aktueller Entwicklungsstatus ist unbekannt. Moderna behauptete, die LNP-Formulierung sei die gleiche wie in SPIKEVAX und daher sei die Studie mit mRNA-1674 “unterstützend” für die Entwicklung von SPIKEVAX. Diese Behauptung ist unredlich. Zwar kann die Kinetik des Produkts auf diese Weise untersucht werden, die Toxizität jedoch nicht! Wir wissen nicht, was mit den Organen und Geweben geschieht, wenn die gelieferte mRNA beginnt, Spike-Proteine in diesen Zellen zu exprimieren. Dies ist ein entscheidender Sicherheitsaspekt, der sowohl dem Hersteller als auch der Aufsichtsbehörde bekannt war, aber ignoriert wurde.
![]()
Die Studie zeigte, dass die LNPs nicht ausschließlich an der Impfstelle verbleiben, sondern in allen untersuchten Organen mit Ausnahme der Niere vorkommen. Hohe Konzentrationen wurden in den Lymphknoten und der Milz beobachtet, die auch noch 3 Tage nach der Injektion in diesen Organen vorhanden waren. Die Studie wurde abgebrochen, bevor eine vollständige Beseitigung des Wirkstoffs beobachtet werden konnte, daher liegen keine Erkenntnisse über den vollständigen zeitlichen Verlauf der Biodistribution vor. Weitere Organe, in denen der Impfstoff nachgewiesen wurde, waren Knochenmark, Gehirn, Auge, Herz, Dünndarm, Leber, Lunge, Magen und Hoden. In Anbetracht der Tatsache, dass die LNPs und die mRNA-1647 in all diesen Geweben nachgewiesen wurden, kann man davon ausgehen, dass sich die LNPs, die die mRNA-1273 enthalten, ebenfalls auf die gleiche Weise verteilen und das Spike-Protein daher von den Zellen in diesen kritischen Orangen mit unvorhersehbaren und möglicherweise katastrophalen Auswirkungen exprimiert werden würde. Weder Moderna noch die FDA wollten diese Angelegenheit weiter untersuchen.
![]()
Es wurden keine Studien zum Stoffwechsel, zur Ausscheidung, zu pharmakokinetischen Wechselwirkungen mit Arzneimitteln oder anderen pharmakokinetischen Untersuchungen für mRNA-1273 durchgeführt. Es gab keine sicherheitspharmakologischen Bewertungen für irgendwelche Organe wie Herz-Kreislauf-System, Zentralnervensystem, Leber, Milz, usw.
![]()
Im gesamten Paket war nur eine einzige toxikologische Studie enthalten, die sich auf den richtigen Prüfgegenstand (mRNA-1273) bezog. Die Studie war jedoch nicht GLP-konform und war zum Zeitpunkt der Unterlageneinreichung bei der FDA noch nicht abgeschlossen. Diese Studie trägt den Titel “5 week (2 doses) repeat immunogenicity and toxicity study” (“5 Wochen (2 Dosen) Wiederholungsstudie zur Immunogenität und Toxizität”) und wurde an Ratten durchgeführt. Diese Studie ist sehr kurz beschrieben und verweist auf die vollständigen Berichte in Modul 2.6.2, das nicht im HHS-Paket enthalten ist. Die Zusammenfassung der Ergebnisse enthält die folgende Aussage zu den Sicherheitsbeobachtungen:
![]()
“Es gab keine mRNA-1273-bedingten Auswirkungen auf das Körpergewicht. mRNA-1273-bedingte klinische Anzeichen wurden an Tag 1 und Tag 22 beobachtet, beginnend mit der 30 µg/Dosis. Klinische Anzeichen, die aus einem vorübergehenden, dosisabhängigen Ödem an der Injektionsstelle mit oder ohne Beeinträchtigung der Hinterbeine bestanden, wurden etwa 24 Stunden nach der Verabreichung der Dosis beobachtet und bildeten sich im Allgemeinen innerhalb von 7 Tagen nach Verabreichung der Dosis zurück. mRNA-1273-bedingte klinisch-pathologische Veränderungen im Zusammenhang mit Entzündungen, einschließlich erhöhter Neutrophilen-, Eosinophilen- und/oder Globulinwerte, wurden ab der 30 µg/Dosis beobachtet. Andere leichte mRNA-1273-bedingte Veränderungen, die bei 30, 60 und/oder 100 µg/Dosis beobachtet wurden, bestanden in einer Abnahme der roten Blutkörperchen, der Retikulozyten und der Lymphozyten sowie in einem Anstieg von Kreatinin, Triglycerid, Cholesterin und/oder Glukose. Im Allgemeinen stimmen diese Veränderungen mit den Ergebnissen der früheren GLP-Studien zur Rattentoxizität überein, die mit dem SM-102 LNP des Auftraggebers durchgeführt wurden.”
In einem separaten Teil des Datenpakets findet sich ein aktualisierter Absatz zu den Ergebnissen dieser Studie, der wie folgt lautet:
![]()
“Postmortale artikelbezogene und allgemein dosisabhängige Veränderungen der Organgewichte und der makroskopischen und mikroskopischen Ergebnisse wurden bei ≥ 8,9 µg/Dosis beobachtet. Organgewichtszunahmen wurden bei der Milz, der Leber und der Nebenniere beobachtet. Die Organgewichtsveränderungen kehrten sich im Allgemeinen bis zum Ende der 2-wöchigen Erholungsphase um. Zu den makroskopischen Veränderungen gehörten Hautverdickungen an der Injektionsstelle und vergrößerte Lymphknoten. Die Veränderungen an der Injektionsstelle bildeten sich vollständig zurück und die Lymphknotenveränderungen erholten sich bis zum Ende des zweiwöchigen Erholungszeitraums. Zu den mikroskopischen Veränderungen gehörten eine gemischtzellige Entzündung an der Injektionsstelle, eine erhöhte Zellularität und eine gemischtzellige Entzündung in den Leisten-, Iliakal- und Popliteal-Lymphknoten, eine verringerte Zellularität in der periarteriolären Lymphoidscheide der Milz, eine erhöhte myeloische Zellularität im Knochenmark sowie eine Hepatozytenvakuolation und eine Kupfferzellhypertrophie in der Leber. Die mikroskopischen Veränderungen bildeten sich im Allgemeinen bis zum Ende der zweiwöchigen Erholungsphase zurück.”
Diese Indikatoren deuten auf mögliche Gewebeschäden, systemische Entzündungen und potenziell schwerwiegende Sicherheitsprobleme hin und sind zudem dosisabhängig. Aussagen wie “Lymphknotenveränderungen erholten sich” sind ein Eingeständnis, dass das Produkt mit einem potenziell schwerwiegenden Sicherheitssignal in Verbindung steht, das zum Zeitpunkt der Beendigung der Studie noch nicht abgeschlossen war. Moderna hat dies jedoch zur Kenntnis genommen und einfach weitergemacht und beschlossen, auf eine weitere Bewertung dieser Auswirkungen zu verzichten.
![]()
Ergebnis 4: Es gibt zwei verschiedene Zulassungsnummern für mRNA-1273: eine wird von Moderna, die andere von DMID (NIH) gehalten, was einen schwerwiegenden Interessenkonflikt darstellt.
In den Unterlagen von Moderna heißt es: “Ein Schreiben von DMID [Division of Microbiology and Infectious Diseases am NIH], das die US Food and Drug Administration (FDA) ermächtigt, sich auf IND#19635 zu beziehen, um die Prüfung dieser IND [Modernas eigene IND# 19745] zu unterstützen, ist in Modul 1.4 enthalten” (das Modul ist nicht im Dokumentenpaket des HHS enthalten).
![]()
Das Dokument “Summary Basis for Regulatory Action SPIKEVAX” [Zusammenfassende Grundlage für regulatorische Maßnahmen]8 der FDA vom 30. Januar 2022 enthält den folgenden Zeitplan für das Produkt von Moderna:
![]()
Diesem Zeitplan zufolge hat das Produkt zwei Träger/Eigentümer (Inhaber der “Investigational New Drug”-Antragspakete9 ), von denen einer die Abteilung der NIH ist, die organisatorisch Anthony Fauci untersteht. Das Datum des Pre-IND-Meetings für SPIKEVAX ist der 19. Februar 2020, die Einreichung des IND-Antrags für das NIH ist am darauffolgenden Tag, dem 20. Februar, während der IND-Antrag von Moderna am 27. April 2020 eingereicht wurde. Zur Erinnerung: Nach Angaben der CDC haben die chinesischen Gesundheitsbehörden am 11. Januar 2020 mehr als 40 Infektionen beim Menschen im Rahmen dieses Ausbruchs identifiziert, der erstmals am 31. Dezember gemeldet wurde. Die Weltgesundheitsorganisation gab die vorläufige Identifizierung des neuartigen Coronavirus am 9. Januar bekannt. Der Datensatz von Wuhan-Hu-1 enthält Sequenzdaten, Anmerkungen und Metadaten dieses Virus, das etwa zwei Wochen zuvor von einem Patienten isoliert wurde.
![]()
Dies wirft mehrere Fragen auf, die einer weiteren Untersuchung bedürfen:
![]()
- Wie war es möglich, dass NIH/Moderna einen Monat vor der Ausrufung der Covid-Pandemie das Pre-IND-Meeting für eine klinische Phase-1-Studie mit der FDA für ein Impfstoffprodukt angesetzt hat? Die Vorbereitung eines Pre-IND-Meetings ist in der Regel ein mehrmonatiger, teurer und arbeitsaufwändiger Prozess.
- Wie war es möglich, alle Materialien vorzubereiten und den gesamten nicht-klinischen Testprozess für dieses spezielle Produkt, das sich auf ein sehr spezifisches Virus bezieht, das erst am 9. Januar 2020 isoliert und sequenziert wurde (so wurde es uns gesagt), abzuschließen?
- Wie sieht die genaue kommerzielle und rechtliche Vereinbarung zwischen Moderna und NIH in Bezug auf SPIKEVAX aus? Die Inhaberschaft an der IND ist sowohl eine rechtliche als auch eine kommerzielle Angelegenheit, die im Falle einer öffentlich-privaten Partnerschaft transparent offengelegt werden muss.
- Profitiert das NIH finanziell vom Verkauf des Moderna-Produkts? Wer beim NIH konkret?
- Stellt das Erzwingen von Impfungen mit dem Moderna-Produkt durch Vorschriften, staatlich finanzierte Medienkampagnen und perverse finanzielle Anreize der Regierung für Schulen, Gesundheitssysteme und Arbeitgeber einen erheblichen Interessenkonflikt für das NIH als finanziellen Nutznießer dieser Maßnahmen dar?
- Stellt das Verschweigen wichtiger Sicherheitsinformationen (siehe Abschnitt 6) durch eine finanziell interessierte Partei (NIH und Moderna) eine Verschwörung des Pharma-Regierungskartells zum Betrug an der Öffentlichkeit dar?
Interessant ist auch, dass unmittelbar nach dem Pre-IND-Meeting mit der FDA ein extrem hohes Volumen an Zeichnungen von Moderna-Aktien an den öffentlichen Märkten platziert wurde. Dies würde eine zusätzliche Untersuchung der Investoren rechtfertigen, die in der Lage waren, die spektakuläre Zukunft der zuvor schlecht abschneidenden Aktie mit einer derartigen Präzision vorherzusagen.
![]()
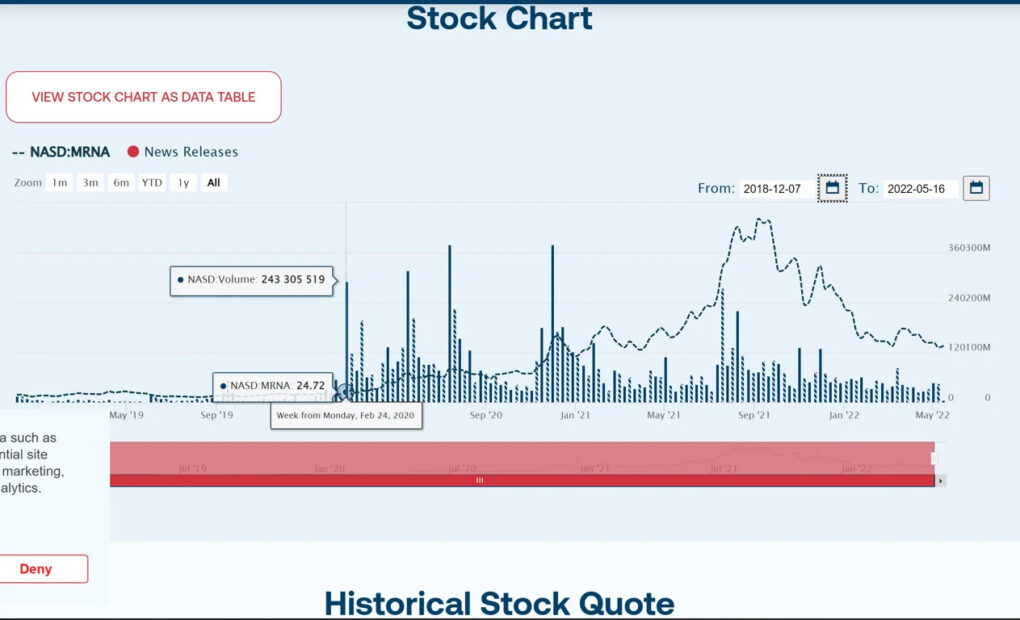
Ergebnis 5: Eine durch den Impfstoff ausgelöste, durch Antikörper verstärkte Krankheit wurde als ernstes Risiko eingestuft und von Moderna nicht ausgeschlossen, da es keine Positivkontrolle gab und nicht validierte Forschungsmethoden angewandt wurden.
Vor 2020 war Moderna nicht in der Lage, ein Produkt auf den Markt zu bringen. Die gesamte Produktentwicklungsgeschichte des Unternehmens war von zahlreichen Misserfolgen gekennzeichnet, obwohl Millionen von Dollar und viel Zeit in die Entwicklung investiert wurden. Insbesondere die mRNA-basierten Impfstoffe des Unternehmens wurden mit dem Phänomen der infektionsverstärkenden Antikörper (ADE) in Verbindung gebracht. Ein Beispiel dafür ist die präklinische Studie von Moderna zu einem mRNA-basierten Zika-Impfstoff, bei der alle geimpften Mäuse “einheitlich an einer tödlichen Infektion und schweren Krankheit aufgrund von Antikörperverstärkung [litten] ….”10 Die Wissenschaftler waren in der Lage, einen Impfstofftyp (IgEsig-prM-E FL) zu entwickeln, der Schutz gegen Zika bot und “zu deutlich weniger Morbidität und Mortalität führte”, obwohl alle Versionen des Impfstoffs eindeutig zu einem gewissen Grad von ADE führten (bis zum fünften Tag sank die Überlebensrate bei Mäusen, die mit IgEsig-prM-E FL geimpft worden waren, auf 80%; das bedeutet, dass 20% der geimpften Mäuse aufgrund der durch den Impfstoff verursachten ADE gestorben waren).
![]()
Der Abschnitt über die primäre Pharmakologie von SPIKEVAX umfasste 9 Studien zur Bewertung der Immunogenität, des Schutzes vor der viralen Replikation (deklarierter Wirkmechanismus) und zur Bewertung des Potenzials für durch den Impfstoff ausgelöste verstärkte Atemwegserkrankungen. Diese Studien enthielten den richtigen Prüfgegenstand (mRNA-1273), waren jedoch alle nicht GLP-konform. Die Ergebnisse dieser Studien werden im Text des Dokumentenpakets kurz zusammengefasst, die Studienberichte sind jedoch nicht enthalten. Auf S.-000150 behauptet Moderna, dass es für das SARS-Cov-2-Virus aufgrund seiner extremen Neuartigkeit “keine etablierten Tierversuche gab”. Im nächsten Satz heißt es, dass Dr. Ralph Baric von der University of North Carolina in Chapel Hill trotz der völligen Neuartigkeit des Virus praktischerweise einen bereits an Mäuse angepassten SARS-Cov-2-Virusstamm besaß und diesen für einige der Moderna-Studien zur Verfügung stellte. An anderer Stelle, auf S.-0001468, stellt das Unternehmen richtigerweise fest, dass die erhöhte Besorgnis über Atemwegserkrankungen unter anderem durch präklinische Arbeiten an SARS-CoV- und MERS-CoV-Impfstoffen ausgelöst wurde – es scheint also, dass das Unternehmen seinen eigenen Aussagen über fehlende präklinische SARS-Modelle widerspricht. Während Moderna das erhöhte Risiko einer Atemwegserkrankung erörtert, werden die eigenen Ergebnisse mit dem Hinweis auf die Ungültigkeit der verwendeten Tests und Methoden abgetan:
![]()
“Da die SARS-CoV-2-Neutralisierungstests zum jetzigen Zeitpunkt noch sehr variabel sind und noch weiterentwickelt, optimiert und validiert werden, sollten die Studienmessungen nicht als aussagekräftiger Prädiktor für die klinischen Ergebnisse angesehen werden, insbesondere wenn keine Ergebnisse einer Positivkontrolle vorliegen, die eine Krankheitsverstärkung aufgezeigt hat”.
Es ist klar, dass sowohl Moderna als auch die FDA von der Krankheitsverstärkung wussten und sich zahlreicher Beispiele dieses gefährlichen Phänomens bewusst waren, darunter auch Modernas eigenes Zika-Impfstoffprodukt desselben Typs. Dennoch hat die FDA die wissenschaftlich unredlichen “Studien” von Moderna nicht in Frage gestellt, die dieses äußerst signifikante Risiko ohne ein angemessenes Studiendesign ausschlossen.
![]()
Ergebnis 6: FDA und Moderna haben in öffentlichen Bekanntmachungen und bei der Produktkennzeichnung über reproduktionstoxikologische Studien gelogen.
Schauen wir uns die Ergebnisse an, die Moderna der FDA vorgelegt hat und was die FDA ihrerseits den medizinischen Einrichtungen und der Öffentlichkeit mitgeteilt hat.
![]()
Moderna führte eine Studie zur Reproduktionstoxikologie an trächtigen und säugenden Ratten mit einer Humandosis von 100 mcg mRNA-1273 durch (beschrieben auf S. -0001150). Der vollständige Studienbericht war nicht Bestandteil der Unterlagen. In der Zusammenfassung der Ergebnisse schrieb Moderna jedoch:
![]()
“Hohe IgG-Antikörper gegen SARS-CoV-2 S-2P wurden auch bei GD 21 F1-Föten und LD 21 F1-Welpen beobachtet, was auf eine starke Übertragung von Antikörpern vom Muttertier auf den Fötus und vom Muttertier auf die Welpen hinweist.”
Die Sicherheitsbewertungen in der Studie scheinen sehr begrenzt zu sein, jedoch werden die folgenden Ergebnisse von Moderna beschrieben:
![]()
Die Mütter verloren nach der Verabreichung des Impfstoffs ihr Fell, was mehrere Tage lang anhielt. Es liegen keine Informationen darüber vor, wann dies vollständig behoben war, da die Studie beendet wurde, bevor dies beurteilt werden konnte.
![]()
Bei den Welpen wurden die folgenden Skelettfehlbildungen beobachtet:
![]()
“In der F1-Generation [Rattenwelpen] gab es keine mRNA-1273-bedingten Auswirkungen oder Veränderungen bei den folgenden Parametern: Sterblichkeit, Körpergewicht, klinische Beobachtungen, makroskopische Beobachtungen, grobe Pathologie, äußere oder viszerale Missbildungen oder Veränderungen, Skelettmissbildungen und durchschnittliche Anzahl der Verknöcherungsstellen pro Fötus und Wurf. mRNA-1273-bedingte Veränderungen bei der Skelettuntersuchung umfassten statistisch signifikante Erhöhungen der Anzahl von F1-Ratten mit einer oder mehreren wellenförmigen Rippen und einem oder mehreren Rippenknötchen. Gewellte Rippen traten bei 6 Föten und 4 Würfen mit einer fetalen Prävalenz von 4,03% und einer Wurfprävalenz von 18,2% auf. Rippenknötchen traten bei 5 dieser 6 Föten auf.”
Moderna brachte die Skelettfehlbildungen sogar mit den Tagen in Verbindung, an denen bei den Müttern eine Toxizität festgestellt wurde: “Mütterliche Toxizität in Form von klinischen Beobachtungen wurde 5 Tage nach der letzten Dosis (GD 13) beobachtet, was mit dem empfindlichsten Zeitraum für die Rippenentwicklung bei Ratten (GD 14 bis 17) korreliert”…. und fuhr fort, dieses Ergebnis als nicht mit dem Impfstoff zusammenhängend abzutun.
![]()
Die FDA hat dann im Namen von Moderna in dem Dokument “Basis for Regulatory Action Summary”11 (Abschnitt 4: Nichtklinische Reproduktionstoxikologie, S.14) gelogen:
![]()
“In der Studie wurden keine impfstoffbedingten fötalen Missbildungen oder Abweichungen und keine nachteiligen Auswirkungen auf die postnatale Entwicklung beobachtet. Immunoglobulin G (IgG)-Reaktionen auf das vor der Fusion stabilisierte Spike-Protein-Antigen wurden nach der Immunisierung in mütterlichen Proben und in Ratten der F1-Generation beobachtet, was auf eine Übertragung von Antikörpern von der Mutter auf den Fötus und von der Mutter auf die säugenden Welpen hinweist.”
Zusammenfassend lässt sich sagen, dass die aus dem Impfstoff stammenden Antikörper von der Mutter auf das Kind übertragen werden. Moderna hat nie untersucht, ob die LNPs, die mRNA und die Spike-Proteine ebenfalls übertragen werden, doch es ist anzunehmen, dass dies aufgrund des Wirkmechanismus dieser Produkte der Fall ist. Dies hätte getestet und die Risiken für das Kind hätten bewertet werden müssen, da die wichtigsten Stoffwechselorgane des Babys, wie die Leber, sehr klein sind. Jegliche “Überdosierung” oder unkontrollierte Freisetzung von Toxinen wie Spike-Protein könnte ein ernsthaftes lebensbedrohliches Risiko darstellen. Dies wurde den schwangeren und stillenden Frauen, die zu diesen experimentellen Injektionen gedrängt und genötigt wurden, nie mitgeteilt. Die FDA/CDC beantragte nicht, schwangere und stillende Frauen aus der Bevölkerungsgruppe auszuschließen, für die der Impfstoff empfohlen werden sollte, bis solche Studien abgeschlossen werden konnten. Die FDA hat dann gelogen und behauptet, dass in der nicht-klinischen Studie an Rattenwelpen “keine Skelettmissbildungen” aufgetreten seien, obwohl dies eindeutig von Moderna berichtet wurde und sogar statistisch und zeitlich mit den trächtigen Ratten zusammenhing, die klinische Anzeichen von impfstoffbedingter Toxizität zeigten. Selbst wenn die “Expertenmeinung” der FDA lautete, dass es keinen Zusammenhang gibt, sollten wir uns die Frage stellen, warum sie die kritischen sicherheitsrelevanten Informationen vor der Öffentlichkeit verbergen und das Produkt besser aussehen lassen, als der Hersteller zugegeben hat? Der FDA lagen keine objektiven wissenschaftlichen Beweise vor, die einen Zusammenhang zwischen den Skelettfehlbildungen und dem Impfstoff ausschließen. Daher hätten die Informationen auf dem Etikett dieses experimentellen und schlecht getesteten Produkts vollständig offengelegt werden müssen, anstatt sie über ein Jahr lang vor der Öffentlichkeit zu verbergen und dann erst auf richterliche Anordnung hin offenzulegen.
![]()
Welche nichtklinischen Sicherheitsdaten hat die FDA letztendlich für die Zulassungsentscheidung verwendet?
Pharmahersteller sind von Natur aus voreingenommen, da sie ein persönliches kommerzielles Interesse an ihren Produkten haben. Diese Voreingenommenheit kann sie dazu verleiten, bei den Sicherheitstests Abstriche zu machen. Aus diesem Grund gibt es in den Vereinigten Staaten und weltweit staatliche Aufsichtsbehörden wie die FDA, die mit der Festlegung von Standards und der Bewertung von Arzneimitteltests betraut sind, bevor diese auf den Markt kommen. Die Behörden sind mit einem milliardenschweren Budget ausgestattet; allein die FDA beschäftigt rund 19.000 erstklassig ausgebildete Fachleute aus den Bereichen Biologie, Chemie, Pharmakologie, Toxikologie und anderen einschlägigen Wissenschaften. Es sollte für die FDA-Prüfer ein Leichtes sein, den eklatanten Betrug, die Auslassungen, die Verwendung ungeeigneter Studiendesigns und den allgemeinen Mangel an wissenschaftlicher Sorgfalt zu durchschauen. Allein die Tatsache, dass mehr als die Hälfte des Pakets nicht GLP-konforme Studien für irrelevante, nicht zugelassene und bereits gescheiterte chemische Substanzen enthält, hätte ein ausreichender Grund sein müssen, dieses Produkt nicht zuzulassen. Vor 2020 wäre dies sicherlich auch der Fall gewesen.
![]()
In dem von der FDA veröffentlichten Dokument “Summary Basis for Regulatory Action SPIKEVAX” vom 30. Januar 2022 wird in Abschnitt 4 “Nonclinical Pharmacology/Toxicology” zusammengefasst, welche Teile des unsinnigen nichtklinischen Pakets von Moderna von der Behörde bei der Zulassung des Produkts berücksichtigt wurden. Die Zusammenfassung besteht aus einer Seite.
![]()
Es scheint, dass die FDA ihre Entscheidung, dass das Produkt für die Verabreichung an Tausende ansonsten gesunder Menschen sicher ist, auf zwei Studien an Ratten stützte: die Studie zur Reproduktionstoxikologie (Ergebnis 6 oben) und die Studie zur Toxizität bei wiederholter Verabreichung (Ergebnis 3 oben). Der Rest des 700-seitigen Pakets wurde als “andere unterstützende Studien” bezeichnet. Die FDA merkte an, dass sie mit “fünf Impfstoffen, die in SM-102-Lipidpartikeln formuliert sind und mRNAs enthalten, die für verschiedene virale Glykoprotein-Antigene kodieren” durchgeführt wurden.
![]()
Die ehrwürdigen Regulierungsbehörden kamen also zu dem Schluss, dass die Verwendung neuer, nicht zugelassener mRNAs zur Unterstützung einer anderen, nicht zugelassenen neuen mRNA akzeptabel sei! Die zirkuläre Logik ist verblüffend. Die Aufsichtsbehörden, die die Verwendung gescheiterter Experimente zur Unterstützung eines anderen neuen Experiments direkt an der ahnungslosen Öffentlichkeit zulassen (und persönlich fördern), sind selbst ein gefährliches Versagen. Die FDA, die Pharmaindustrie und alle anderen, die diesen Betrug begehen, müssen dringend gestoppt und überprüft werden.
![]()
Quellen[+]
Autorin: Sasha Latypova
![]()
Am 06.07.22 erschienen auf: https://www.trialsitenews.com/a/modernas-non-clinical-summary-for-spikevax-evidence-of-scientific-and-regulatory-fraud-fd53b4f7
![]()


 Spendier mir 'nen Kaffee
Spendier mir 'nen Kaffee