Von Sonia Elijah / Trial Site News
![]()
Trial Site News konnte kürzlich durchgesickerte interne E-Mails der Europäischen Arzneimittelagentur (EMA) und Sitzungsberichte zwischen der Agentur und Pfizer einsehen. Die EMA beaufsichtigt die Bewertung und Überwachung von Arzneimitteln in der Europäischen Union. Wie andere Gesundheitsbehörden ist sie in erster Linie für den Schutz und die Förderung der öffentlichen Gesundheit zuständig. Auszüge aus der internen E-Mail-Korrespondenz der EMA, eine PowerPoint-Präsentation vom 26. November 2020 von einem entscheidenden Treffen zwischen Pfizer und der Behörde sowie ein vertraulicher 43-seitiger Bericht von Pfizer wurden uns von einer anonymen Quelle zur Verfügung gestellt, weil sie dem Engagement von Trial Site für Transparenz, Zugänglichkeit und Rechenschaftspflicht zur Förderung einer hochgradig ethischen, qualitätsorientierten und auf die öffentliche Gesundheit ausgerichteten biomedizinischen Forschungsindustrie vertraut.
![]()
Aufsichtsbehörden wie die EMA, die Food and Drug Administration (FDA) in den USA und die britische Medicines and Healthcare products Regulatory Agency (MHRA) haben den Auftrag, Entscheidungen zum Wohle der Öffentlichkeit zu treffen. Äußere Einflüsse wie politischer oder medialer Druck sollen bei der Entscheidungsfindung keine Rolle spielen. Als es jedoch um die Pandemiebedingungen und die beschleunigte bedingte Zulassung der Corona-Impfstoffe (insbesondere für die von Pfizer-BioNTech und Moderna hergestellten mRNA-basierten Impfstoffe) ging, schien letzteres den Ausschlag zu geben.
![]()
Der Zeitraum der fraglichen E-Mail-Korrespondenz erstreckt sich vom 10. bis 25. November 2020, also nur wenige Wochen, bevor die EMA am 21. Dezember 2020 die CMA (bedingte Marktzulassung) für den Pfizer-BioNTech-Impfstoff erteilte. Die FDA erteilte die EUA (Emergency Use Authorisation, Notfallzulassung) für diesen Impfstoff am 11. Dezember, während die MHRA am 2. Dezember als erste die Ziellinie erreichte. Die Autorin verwendet hier den Begriff “Ziellinie”, da die E-Mails einen intensiven, fast wettbewerbsähnlichen Wettlauf um die schnellstmögliche Zulassung der Corona-Impfstoffe erkennen lassen. Bekanntermaßen wurde die Welt zu dieser Zeit von einer Pandemie heimgesucht, so dass die Zulassung eines Impfstoffs zum Schutz vor dem neuartigen Coronavirus mit großem Nachdruck vorangetrieben wurde.
![]()
Der Wettlauf um die Notfallzulassung
In einer E-Mail von Marco Cavaleri, dem damaligen Leiter der Abteilung für biologische Gesundheitsbedrohungen und Impfstoffstrategie der EMA, wurde mit Nachdruck mitgeteilt, dass die amerikanische Arzneimittelbehörde FDA “im Begriff ist, sich mit der Notfallzulassung zu beeilen”.
![]()
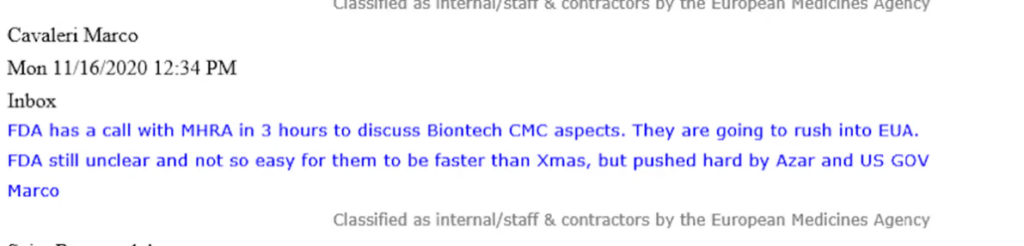
Cavaleri verweist darauf, dass diese “Eile” “von Azar und der US-Regierung stark vorangetrieben” wurde. Unter der Trump-Regierung war der ehemalige Pharmamanager Alex Azar von 2018 bis 2021 Minister für Gesundheit und humane Angelegenheiten (HHS) der Vereinigten Staaten. Die FDA ist eine Behörde, die direkt dem HHS unterstellt ist.
![]()
Interessanterweise sind die Arzneimittelpreise unter Azars Führung als ehemaliger Präsident von Lilly USA LLC, einer Abteilung von Eli Lilly, in die Höhe geschossen. Während seiner Amtszeit war das Pharmaunternehmen auch in eine Sammelklage verwickelt, in der es beschuldigt wurde, das Arzneimittelpreissystem auszunutzen, um die Gewinne für sein Insulinpräparat zu steigern. Das bedeutet natürlich nicht unbedingt, dass diese Führungskraft in irgendeiner Weise mitschuldig war, doch der Zeitpunkt ist bemerkenswert.
![]()
Cavaleris E-Mail macht deutlich, wie sehr die Politik (und die US-Regierung) den Regulierungsprozess der FDA vorantreibt und dafür sorgt, dass er in Windeseile (“warp speed”) vonstatten geht. Und natürlich sollte Trumps Operation Warp Speed sicherstellen, dass alle Rekorde in der Impfstoffentwicklung gebrochen werden. Die Absichten waren angesichts des Ausbruchs der schlimmsten Pandemie des letzten Jahrhunderts zweifelsohne gut.
![]()
Jenseits des Atlantiks, in den europäischen Zulassungsbehörden, stieg jedoch die Spannung, da der Druck, die Fristen zu verkürzen, die Atmosphäre und die allgemeine Stimmung anspannte – der Druck und die Angst waren in den überprüften E-Mail-Wechseln deutlich zu spüren.
![]()
Personen mit hoher Integrität und Klarheit über ihre Rolle und Verpflichtungen als Verwalter der öffentlichen Gesundheit traten hervor. So zeigte sich beispielsweise eine Person spürbar besorgt angesichts des beschleunigten Zeitplans, der sicherstellen sollte, dass die “Frist” für die Impfstoffzulassung auf Kosten einer soliden Bewertung eingehalten werden würde. Es handelte sich um Noel Wathion, den damaligen stellvertretenden Exekutivdirektor der EMA, der inzwischen in den Ruhestand getreten ist. Dieser EMA-Beamte wies mit Nachdruck darauf hin:
![]()
“Wir beschleunigen das Verfahren so weit wie möglich, aber wir müssen auch sicherstellen, dass unsere wissenschaftliche Bewertung so solide wie möglich ist. Wir dürfen nicht vergessen, dass die Empfehlung an die Europäische Kommission, eine CMA zu erteilen, mit Verantwortung und Rechenschaftspflicht verbunden ist”.

Wathion geht davon aus, dass die Notfallzulassung der FDA (und der MHRA) erteilt werden würde, bevor die EMA ihre eigene CMA erteilt, was sich als richtig herausstellte. Interessant ist seine Sorge um die “Schadensbegrenzung”, die sich aus dem wahrscheinlichen Ergebnis ergibt, dass die EMA in diesem regulatorischen Wettlauf das Schlusslicht bildet, und seine Befürchtung, dass sich dadurch die öffentliche Meinung und die Medien gegen die Behörde wenden würden. Eine sorgfältige Durchsicht dieser E-Mails zeigt, dass Schnelligkeit offenbar wichtiger war als die Qualität.
![]()
In einer E-Mail vom 19. November berichtet Wathion von einer “ziemlich angespannten” Telefonkonferenz mit der Kommissionspräsidentin (Ursula von der Leyen), die “manchmal sogar etwas unangenehm” war. Darin spiegelt sich der wachsende Druck wider, unter dem die EMA-Mitarbeiter standen, um nach der von der FDA/MHRA erteilten Notfallzulassung für den Impfstoff von Pfizer-BioNTech rasch eine CMA zu erteilen. Von der Leyen ist möglicherweise für dieses angespannte Umfeld verantwortlich, da “eine Verzögerung von mehreren Wochen … für die EK [Europäische Kommission] nicht ohne weiteres akzeptabel ist”.
![]()
Anfang 2022 berichtete Trial Sites News, wie von der Leyen in einen Skandal verwickelt wurde, als eine Gruppe unabhängiger Europaabgeordneter ihren sofortigen Rücktritt und die vollständige Offenlegung einer Reihe privater Textnachrichten zwischen ihr und dem CEO von Pfizer Albert Bourla forderte. Nur ein kleiner Teil dieser Texte wurde jemals veröffentlicht. Diese enthüllten, dass sie Teile eines europaweiten Impfstoffabkommens einseitig mit Bourla über eine Reihe von SMS verhandelte! Offensichtlich wurden die Standardprotokolle in Europa zugunsten der Zweckmäßigkeit über den Haufen geworfen, und dies war offenbar mit einem einheitlichen Wettbewerbsdruck auf alle drei Zulassungsbehörden verbunden.
![]()
Wathion legt seine Überlegungen nach dieser speziellen Telefonkonferenz offen und schreibt schockiert, dass “die politischen Auswirkungen zu groß zu sein scheinen, selbst wenn die ‘technische’ Ebene der Mitgliedstaaten eine solche Verzögerung verteidigen könnte, um das Ergebnis der wissenschaftlichen Überprüfung so solide wie möglich zu gestalten”. Anders ausgedrückt: Die kontinuierliche Darstellung von Wissenschaft erschien zunächst als Deckmantel für die Politik.
![]()

Wathion weist darauf hin, dass eine mögliche Verzögerung von mehreren Wochen, um eine “solide Sicherheit insbesondere in Bezug auf CMC und Sicherheit” zu gewährleisten, auf “Kritik von verschiedenen Seiten” stoßen wird, einschließlich der Medien, der Europäischen Kommission und des Europäischen Parlaments (EP). Wathion spricht von seiner Befürchtung, dass wir von allen Seiten überrannt werden und mitten im Sturm stehen, wenn die Frist nicht eingehalten werden kann, “um uns so weit wie möglich an den Zeitplan für die Zulassung durch die FDA/MHRA anzupassen”. Diese potenzielle Verzögerung scheint jedoch notwendig zu sein, “um das Ergebnis der wissenschaftlichen Prüfung so robust wie möglich zu gestalten”. Dies impliziert, dass Schnelligkeit auf Kosten der Sicherheit das Gebot der Stunde war, um “politische Konsequenzen” zu vermeiden. Offensichtlich diktierte die Politik das Zulassungsprotokoll für den Corona-Impfstoff, nicht die Wissenschaft.
![]()

In der obigen E-Mail von Marco enthüllt der EMA-Beamte, dass der Pfizer-CEO Albert Bourla bei Peter Marks “Lobbyarbeit” geleistet hat, was angesichts der Tatsache, dass Marks der Direktor des Center for Biologics Evaluation and Research (CBER) bei der FDA ist, als höchst umstritten angesehen werden könnte. Der offensichtliche Zugriff von Pfizer auf die Bundesaufsichtsbehörde wirft zumindest erhebliche Fragen auf, wenn er nicht sogar die Möglichkeit beunruhigender Verwicklungen zwischen der Industrie und einer angeblich unabhängigen, wissenschaftlichen Bundesbehörde eröffnet.
![]()
Große Bedenken hinsichtlich der Integrität zwischen den Impfstoffchargen
Aus einer E-Mail von Cavaleri (siehe unten) geht hervor, dass die FDA zu diesem Zeitpunkt “einige Probleme” im Zusammenhang mit dem CMC kannte, die gelöst werden mussten und “am Ende der schwierige Teil sein könnten”. CMC steht für Chemistry, Manufacturing and Controls (Chemie, Herstellung und Kontrollen), auch als pharmazeutische Qualität bezeichnet, und umfasst verschiedene Verfahren zur Bewertung und Gewährleistung der Sicherheit und Konsistenz zwischen den Chargen pharmazeutischer Produkte.
![]()
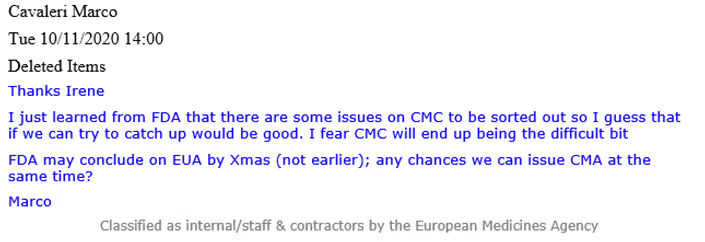
In einer E-Mail von Evdokia Korakianiti (wissenschaftliche Mitarbeiterin der EMA) wird näher erläutert, um welche “Probleme” es sich dabei handelte und dass es sich dabei in der Tat um erhebliche Bedenken im Zusammenhang mit dem Impfstoff von Pfizer und BioNTech handelte.
![]()

Alarmierenderweise wurden signifikante Unterschiede in der mRNA-Integrität zwischen den kommerziellen (Großmaßstab) und den klinischen Impfstoffchargen (Kleinmaßstab) von Pfizer-BioNTech festgestellt. Bei den klinischen Impfstoffchargen lag die mRNA-Integrität bei ca. 78%, bei den vorgeschlagenen kommerziellen Chargen bei ca. 55%, wobei die “Ursache” noch nicht ermittelt wurde. In der E-Mail wurde auch darauf hingewiesen, dass die Auswirkungen auf die Sicherheit und Wirksamkeit “noch zu definieren” seien.
![]()
In einem vertraulichen Pfizer-Bericht, der zusammen mit den EMA-E-Mails durchgesickert ist, gibt das Unternehmen an, dass nach den allgemeinen Erfahrungen von Acuitas Therapeutics (dem Biotech-Unternehmen, das die Lipid-Nanopartikel-Plattform für den Impfstoff von Pfizer und Moderna entwickelt hat) “ein Mindestwert bei etwa 70% liegt”. (Siehe Abbildung unten)
![]()

Auf Seite 30 heißt es dann: Die Wirksamkeit des Produkts hängt von der Expression der gelieferten RNA ab, die ein ausreichend intaktes RNA-Molekül erfordert. (Siehe Abbildung unten)
![]()

Genau diese Formulierung “erfordert ein hinreichend intaktes RNA-Molekül” wurde in der E-Mail von EMA-Mitarbeiterin Evdokia Korakianiti vom 23. November 2020 verwendet, die wir oben angeführt haben – jetzt wissen wir wahrscheinlich, worauf Korakianiti Bezug genommen hat.
![]()
Die Tatsache, dass die kommerziellen Chargen (die weltweit vertrieben werden sollten) einen so deutlich geringeren Grad an mRNA-Integrität (intaktes RNA-Molekül) aufweisen, ist angesichts des engen Zusammenhangs mit der Wirksamkeit und potenziellen Sicherheit des Produkts äußerst bedenklich.
![]()
Am nächsten Tag schreibt Veronika Jekerle, Leiterin des Pharmazeutischen Qualitätsbüros, an Evdokia (siehe unten).
![]()

Der Unterschied bei der Integrität der mRNA wurde erneut als großes Problem genannt, das “von den meisten Mitgliedstaaten geteilt wird” und “potenzielle Auswirkungen auf die Sicherheit” hat. Jekerle hebt fett hervor: “Eine Zulassung bis Ende des Jahres könnte möglicherweise möglich sein, wenn diese Bedenken + GMP ausgeräumt werden.”
![]()
Dies wirft die kritische Frage auf, wie all diese Bedenken ausgeräumt werden konnten, wenn die CMA nur wenige Wochen später, am 21. Dezember, erteilt wurde. Ein möglicher Lösungsansatz wird weiter unten in diesem Bericht erläutert.
![]()
Im Gegensatz zu den Bedenken einiger anderer EMA-Beamter schreibt Marco Cavaleri etwa zur gleichen Zeit in der folgenden E-Mail (siehe unten), dass der mRNA-Gehalt nach Ansicht der FDA kein großes Problem darstelle – “die Frage des mRNA-Gehalts wird nicht als wichtig angesehen”. Außerdem stellt er schockierenderweise fest, dass “unklar ist, ob jemals GCP-Inspektionen durchgeführt wurden”. Diese Enthüllung ist höchst besorgniserregend, denn GCP steht für Good Clinical Practise, einen internationalen ethischen und wissenschaftlichen Qualitätsstandard für die Planung, Durchführung, Aufzeichnung und Berichterstattung von Studien, an denen Menschen teilnehmen.
![]()
Noch beunruhigender ist die folgende Aussage – “kein großes Interesse der FDA” -, die das offensichtliche Desinteresse der Aufsichtsbehörde an der Durchführung von GCP-Inspektionen im Zusammenhang mit den klinischen Studien von Pfizer offenbart, auf die sich die FDA bei der Erteilung der Notfallzulassung für den Impfstoff von Pfizer-BioNTech stützte. In einem der früheren Enthüllungsberichte dieser Autorin für Trial Site News haben wir festgestellt, dass die FDA nur 1% der Studienzentren von Pfizer inspiziert hat.
![]()

Zusätzliche erschütternde Informationen werden durch verschiedene Aufsichtsbehörden enthüllt (siehe Screenshot unten): Health Canada (HC), EMA, MHRA und FDA sind sich alle des Problems mit der prozentualen mRNA-Integrität bewusst, doch die FDA und Health Canada stellen die unbegründete Behauptung auf, dass “die damit verbundenen Sicherheitsbedenken […] eher theoretischer Natur sind”.
![]()

Health Canada scheint sich dann selbst zu widersprechen, denn später heißt es, man sei besonders besorgt darüber, dass eine Region “das gesamte suboptimale Material” erhalte. Offensichtlich wollte man diese Region nicht sein.
![]()
Schockierenderweise steht am Ende der E-Mail:
![]()
“Der Antragsteller [Pfizer] hat der FDA und uns [EMA]/MHRA erst heute mitgeteilt, dass es sich bei den sichtbaren Partikeln im DP [Arzneimittelprodukt] offenbar um Lipid-Nanopartikel-Komponenten handelt.”
Dies ist höchst besorgniserregend, da dieses wichtige Problem den drei wichtigsten Zulassungsbehörden am 25. November mitgeteilt wurde, nur wenige Wochen bevor die EMA die bedingte Zulassung und die FDA die Notfallzulassung für den Pfizer-Impfstoff erteilte. Erschreckenderweise geschah dies nur wenige Tage, bevor die MHRA die Zulassung im Vereinigten Königreich am 2. Dezember 2020 erteilte. Veronikas Vermutung, dass es sich bei den “sichtbaren Partikeln” um LNPs (Lipid-Nanopartikel) handeln könnte, ist nur schwer nachvollziehbar, da Nanopartikel mit dem bloßen Auge nicht sichtbar sind. Andere Abweichungen waren offensichtlich, dennoch war dies wahrscheinlich immer noch ein historischer Versuch in Bezug auf die Geschwindigkeit der Impfstoffentwicklung. Es scheint jedoch klar zu sein, dass etwas mehr Zeit benötigt wurde.
![]()
Wie die prozentuale mRNA-Integrität offenbar behoben wurde
Die Diskrepanz zwischen den Chargen scheint gelöst worden zu sein, denn es wird erwähnt, dass die “letzten Chargen [die bei der FDA eingegangen sind] darauf hindeuten, dass die Prozentzahl intakter RNA wieder bei 70-75% liegt”.
![]()
In einem durchgesickerten Bericht über ein Treffen mit Pfizer und der EMA am 26. November 2020, einen Tag nach Veronikas E-Mail, wird jedoch schockierenderweise enthüllt, dass die Spezifikation für die RNA-Integrität auf >=50% für die Haltbarkeit des Arzneimittels herabgesetzt wurde, was deutlich unter dem von Acuitas Therapeutics geforderten Mindestwert von 70% und den durchschnittlichen 78% der klinischen Chargen liegt. War dies die Art und Weise, wie die EMA (und möglicherweise die FDA/MHRA/HC) das Problem “lösen” wollte, um “eine Zulassung bis Ende des Jahres” zu gewährleisten?
![]()

Es wird erwähnt, dass es “Unsicherheiten hinsichtlich der Konsistenz der Produktqualität und damit Unsicherheiten in Bezug auf die Produktsicherheit und Wirksamkeit des kommerziellen Produkts” gibt. Es ist jedoch rätselhaft, wie eine Herabsetzung der Spezifikation für die RNA-Integrität diesen Haupteinwand ausräumen soll.
![]()
Auf einer anderen Folie heißt es: “Abgeschnittene [verkürzte] und modifizierte RNA-Spezies sollten als produktbezogene Verunreinigungen betrachtet werden.” Damit wird bestätigt, dass diese verkürzten mRNA-Spezies, die das Niveau der prozentualen mRNA-Integrität herabsetzen, als Verunreinigungen eingestuft werden. Ein weiteres alarmierendes Problem, das sich aus diesen Verunreinigungen ergibt, ist folgendermaßen gekennzeichnet: “Die Möglichkeit, dass aus verkürzten und/oder modifizierten mRNA-Spezies andere translatierte Proteine als das beabsichtigte Spike-Protein (S1 S2) resultieren, sollte untersucht werden.” (Siehe Bildschirmfoto unten)
![]()

Die Beweise in diesem Bericht bestätigen, dass Aufsichtsbehörden wie die FDA, die MHRA, die EMA und Health Canada von den Unterschieden zwischen den Chargen in Bezug auf die prozentuale mRNA-Integrität wussten und daher die Auswirkungen auf die “Sicherheit und Wirksamkeit” unbekannt waren. Der durchgesickerte Sitzungsbericht von Pfizer und EMA gibt Anlass zu erheblichen Bedenken, wenn man davon ausgeht, dass das Problem durch eine einfache Herabsetzung der Spezifikation für die RNA-Integrität gelöst wurde. Mit anderen Worten: vielleicht wurde das Problem nie gelöst.
![]()
Eine besondere Website, die in letzter Zeit viel Aufmerksamkeit erregt hat und sich mit den Unterschieden zwischen den Chargen befasst, ist howbadismybatch.com. Es handelt sich um eine umfassende Datenbank mit Analysen zu “Chargencodes und damit verbundenen Todesfällen, Behinderungen und Krankheiten für Corona-Impfstoffe”. Wenn Sie die Chargennummer eines beliebigen Corona-Impfstoffs eingeben, erfahren Sie, wie häufig unerwünschte Ereignisse im Zusammenhang mit dieser Charge gemeldet wurden.
![]()
Ich habe mit Sasha Latypova gesprochen, die seit mehr als 25 Jahren klinische Studien durchführt und ein eigenes Biotech-Unternehmen besitzt, um ihre Expertenmeinung zu den durchgesickerten Dokumenten einzuholen. Sie sagte,
![]()
“Der Mangel an mRNA-Integrität und das Vorkommen von nicht charakterisierten RNA-Fragmenten in Chargen des Pfizer-Produkts wurde als “wichtiger Einwand” bezeichnet – ein formaler behördlicher Hinweis, der als Produktverunreinigung betrachtet wurde und in jedem normalen Arzneimittelzulassungsprozess einen Knackpunkt dargestellt hätte. Zumindest war eine zusätzliche klinische Studie zur Bewertung der klinischen Auswirkungen erforderlich, deren Planung und Durchführung Monate gedauert hätte. Panik setzte sich über die wissenschaftliche Integrität hinweg und es wurde ein willkürlich herabgesetzter Standard für die Akzeptanz der Chargen angenommen, um eine politisch motivierte Frist einzuhalten. Bis heute ist dieses Problem ungelöst und könnte die Ursache für die enormen Unterschiede bei den Raten von unerwünschten Ereignissen und Todesfällen sein, die für verschiedene Chargennummern in den VAERS- und anderen Datenbanken der CDC beobachtet wurden.”
Latypova nahm treffend Bezug auf das Schicksal der Titanic, indem sie einen Vergleich mit der Art und Weise anstellte, wie die Zulassungsbehörden ihr Verfahren zur Genehmigung der Corona-Impfstoffe in “Warp-Speed” durchführten. Der Kapitän der Titanic, Edward J. Smith, wollte die Überfahrtszeit eines anderen Schiffes unterbieten, was dazu führte, dass das Schiff viel zu schnell in Gewässern fuhr, die bekanntermaßen vereist waren. Dadurch kam es zu einer tödlichen Kollision mit einem Eisberg – der Rest ist Geschichte.
![]()
In Anbetracht der in diesem Bericht enthaltenen Beweise und der Tatsache, dass der Impfstoff von Pfizer-BioNTech eines der lukrativsten Produkte der Geschichte ist (im letzten Jahr erzielte Pfizer einen Umsatz von 37 Milliarden Dollar, für 2022 wird ein Umsatz von 32 Milliarden Dollar prognostiziert), möchte die Autorin eine Diskussion über einige wichtige Fragen eröffnen, die von den beteiligten Aufsichtsbehörden, Pfizer und der wissenschaftlichen/medizinischen Gemeinschaft beantwortet werden müssen:
![]()
Welche Auswirkungen auf die Sicherheit und Wirksamkeit hat eine deutlich verringerte mRNA-Integrität (aufgrund einer verkürzten und modifizierten mRNA) in den kommerziellen Chargen dieses Impfstoffs?
![]()
Was genau sind die sichtbaren Partikel, die in dem Arzneimittel beobachtet wurden, das Pfizer in letzter Minute der EMA, der FDA und der MHRA mitgeteilt hat, und welche Auswirkungen hat dies auf die Sicherheit und Wirksamkeit?
![]()
Die Antworten auf diese Fragen sind von großer öffentlicher Bedeutung.
![]()
Autorin: Sonia Elijah
![]()
Am 20.06.22 erschienen auf: https://www.trialsitenews.com/a/what-the-leaked-ema-emails-docs-reveal-major-concerns-with-pfizer-c-19-vaccine-batch-integrity-and-the-race-to-authorise-cdda0ba2
![]()


 Spendier mir 'nen Kaffee
Spendier mir 'nen Kaffee