- 1. Hintergrund
- 2. Die entscheidende Bedeutung von Entzündungen bei der durch Adjuvantien induzierten Immunogenität und Immuntoxizität
- 3. Mercks Begründung für die Verwendung von AAHS als “Placebo” in klinischen Gardasil-Studien
- 4. Sicherheit von Aluminium-Adjuvantien: Was sind die Fakten?
- 5. Informierte Zustimmung in der FUTURE-II-Studie von Merck zu Gardasil in Dänemark
- 6. Widersprüchliche Angaben der Zulassungsbehörden sowie von Merck zur Zusammensetzung und Sicherheit von AAHS
- 7. Risiken und Nutzen der HPV-Impfstoffe
- 8. Beschränkungen
- 9. Schlussfolgerungen
- Danksagung
- Interessenkonflikt
- Finanzierung
Von Lucija Tomljenovic & Leemon B. McHenry / International Journal of Risk & Safety in Medicine
![]()
Das Hauptziel dieser Forschungsarbeit bestand darin, die wissenschaftliche Begründung von Merck für die Verwendung eines reaktogenen aluminiumhaltigen “Placebos” in den klinischen Studien zum HPV-Impfstoff Gardasil vor der Zulassung zu untersuchen. Merck hat gegenüber den Studienteilnehmern mehrere ungenaue Angaben gemacht, die das Recht auf eine informierte Zustimmung beeinträchtigten. Ein reaktogenes Placebo ist eine pharmakologisch wirksame Substanz, die als “Placebo-Kontrolle” getarnt ist; ihre Verwendung in klinischen Studien macht das Konzept einer placebokontrollierten Studie zunichte. Bei mehreren Studienteilnehmern traten chronische, beeinträchtigende Symptome auf, darunter auch bei einigen, die der “Placebo”-Gruppe zugeteilt waren. Es hat darüber hinaus den Anschein, dass Merck sowohl gegenüber den US-amerikanischen als auch den europäischen Aufsichtsbehörden falsche Angaben zu seinem Adjuvans gemacht hat, um Kosten zu sparen.
![]()
1. Hintergrund
Patienten, die an klinischen Studien teilnehmen, begeben sich oft in Gefahr, weil sie zum Fortschritt der medizinischen Wissenschaft beitragen wollen und darauf vertrauen, dass das Risiko ihrer Teilnahme minimiert wird. In den Kodizes der medizinischen Ethik wird die Einwilligung nach Aufklärung als wesentlicher Schutz vor diesem Risiko angesehen. Die Pflicht, eine freie und informierte Einwilligung einzuholen, ergibt sich aus der Achtung der Autonomie der Person bei der Entscheidung, ob sie an einem Experiment teilnimmt.1 Es ist von größter Wichtigkeit, dass der Patient über alle bekannten Risiken aufgeklärt wird, und aus diesem Grund sind Verstöße gegen die Einwilligung nach Aufklärung eine ungeheuerliche ethische Verfehlung.
![]()
Randomisierte, doppelblinde, placebokontrollierte Studien gelten als der “Goldstandard” unter den klinischen Studien und liefern, wenn sie gut konzipiert und durchgeführt werden, den stärksten Beweis für einen Kausalzusammenhang. In solchen Studien ist die Kontrolle ein Placebo, ein “inerter” Ersatz für eine Behandlung oder Intervention, was per Definition bedeutet, dass “die Substanz keine bekannte Aktivität hat, von der man erwarten würde, dass sie das Ergebnis beeinflusst”.2 Wie Rid et al. im Hinblick auf Impfstoffstudien deutlich machen: “Die Randomisierung und die Verwendung von Placebos dienen der Kontrolle von Störfaktoren, so dass signifikante Unterschiede in der Krankheitshäufigkeit oder bei den unerwünschten Wirkungen zwischen der Impfstoff- und der Kontrollgruppe wahrscheinlich auf den Impfstoff zurückgeführt werden können”.3 Ein reaktogenes Placebo ist jedoch eine pharmakologisch wirksame Substanz, die als “Placebo-Kontrolle” getarnt ist; ihre Verwendung in klinischen Studien macht das Konzept einer placebokontrollierten Studie zunichte.
![]()
Die Ausnahmefälle, in denen es als unethisch angesehen wird, ein inertes Placebo zu verabreichen, sind jene, in denen die Vorenthaltung einer aktiven Behandlung bei einem Patienten zu irreversiblen Schäden führen könnte, sowie therapeutische klinische Prüfungen, die darauf abzielen, die Überlegenheit neuer Behandlungen gegenüber bestehenden Behandlungen bei erkrankten Patienten in Bezug auf ihre Wirksamkeit und Sicherheit nachzuweisen. Die Verabreichung einer aktiven Kontrolle, die gesunde Versuchspersonen lediglich Risiken aussetzt, ohne dass diese einen Nutzen davon haben, stellt jedoch einen Verstoß gegen die medizinischen Ethikrichtlinien dar, die vorschreiben, dass die Forschung am Menschen so angelegt sein muss, dass der Schaden minimiert und der Nutzen maximiert wird.4
![]()
Bei Impfstoffstudien ist die Verwendung von inerten Placebos eindeutig akzeptabel, wenn es keinen relevanten sicheren und wirksamen Impfstoff gibt, und umgekehrt ist sie eindeutig inakzeptabel, wenn
![]()
- ein solcher Impfstoff existiert und für die Studienteilnehmer zugänglich ist und
- die Risiken für die Teilnehmer, die sich aus der Verzögerung oder dem Verzicht auf den verfügbaren Impfstoff ergeben, nicht angemessen minimiert oder gemildert werden können.5
Der quadrivalente humane Papillomavirus-Impfstoff (4vHPV) Gardasil von Merck war der erste prophylaktische HPV-Impfstoff, der für die Anwendung bei gesunden Mädchen und Frauen zugelassen wurde,6 7 in erster Linie zur Vorbeugung von Gebärmutterhalskrebs: eine Krankheit, die in den Industrieländern seit vielen Jahrzehnten durch regelmäßige Pap-Abstrich-Screenings erfolgreich verhindert wird.8
![]()
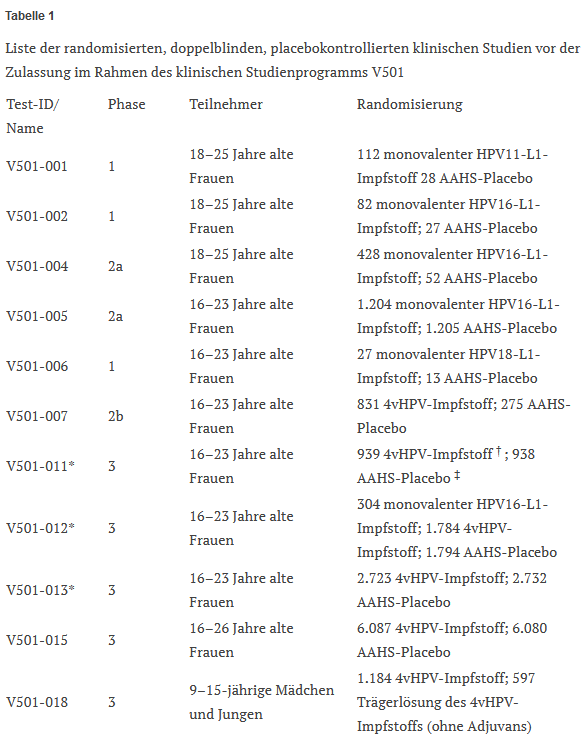
In Anbetracht dieser Tatsachen scheint die Verwendung eines inerten Placebos in den klinischen Studien zu Gardasil, die der Zulassung vorausgingen, eindeutig gerechtfertigt gewesen zu sein. Nichtsdestotrotz verwendete Merck in allen Studien des placebokontrollierten klinischen V501-Studienprogramms vor der Zulassung (Tabelle 1) mit Ausnahme der Studie V501-018 sein firmeneigenes amorphes Aluminiumhydroxyphosphatsulfat (AAHS) als “Placebo”. In der Studie V501-018 wurde jedoch ebenfalls kein Kochsalz-Placebo verwendet, sondern die Trägerlösung des Gardasil-Impfstoffs, die L-Histidin, Polysorbat 80, Natriumborat und Resthefeprotein enthält, das ein potenzielles Allergen ist.9 10 Darüber hinaus wurden nur 1.781 Kinder im Alter von 9 bis 15 Jahren in diese Studie einbezogen; sowohl männliche als auch weibliche, die im Verhältnis 2:1 randomisiert wurden und entweder Gardasil oder das “Placebo” erhielten.11
![]()
Im Gegensatz dazu wurden in die größte Gardasil-Studie V501-015 (die FUTURE-II-Studie), die vor der Zulassung durchgeführt wurde, 12.167 Probanden aufgenommen, allesamt Frauen im Alter von 15 bis 26 Jahren, die im Verhältnis 1:1 randomisiert wurden und entweder Gardasil oder die AAHS-Injektion erhielten.12
![]()
Es ist daher äußerst fraglich, ob die Studie V501-018 angesichts der geringen Größe der Studienpopulation ein zuverlässiges Maß für die Sicherheit von Gardasil darstellt. In diesem Artikel untersuchen wir die Verwendung eines pharmakologisch aktiven aluminiumhaltigen “Placebos” durch Merck in den verbleibenden klinischen Gardasil-Studien vor der Zulassung, die unserer Meinung nach die Bewertung der Sicherheit des Impfstoffs beeinträchtigte und sowohl wissenschaftlich als auch ethisch nicht zu rechtfertigen war.
![]()
2. Die entscheidende Bedeutung von Entzündungen bei der durch Adjuvantien induzierten Immunogenität und Immuntoxizität
Die immunstimulierende Wirkung von Aluminiumadjuvantien wurde 1926 entdeckt.14 Seitdem werden in Human- und Tierimpfstoffen hauptsächlich zwei Arten von Adjuvantien auf Aluminiumbasis verwendet: Aluminiumoxyhydroxid und amorphes Aluminiumhydroxyphosphat. Ersteres wird oft ungenau als “Aluminiumhydroxid” bezeichnet, obwohl es sich dabei chemisch gesehen um AlO(OH) und nicht um Al(OH)3 handelt, während letzteres oft ungenau als “Aluminiumphosphat” bezeichnet wird, obwohl es sich chemisch gesehen um Al(OH)x(PO4)y und nicht um AlPO4 handelt.15 16 AAHS von Merck wird seit 1987 in zugelassenen Humanimpfstoffen verwendet.17 18 Es ist die sulfatierte Form von Aluminiumhydroxyphosphat, und obwohl beide eine ähnliche amorphe Struktur aufweisen, hat AAHS einzigartige Eigenschaften, die seine Fähigkeit erklären könnten, außergewöhnlich hohe und lang anhaltende Antikörperreaktionen hervorzurufen.19 20 21
![]()
Zahlreiche Studien bestätigen, dass Adjuvantien per se gewebeschädigend und entzündungsfördernd sind und dass Entzündungen für die Entwicklung der humoralen Immunität wesentlich sind.22 23 24 25 26 27 28 Dementsprechend konnten Cain et al. zeigen, dass das Ausmaß der humoralen Immunantworten, die durch drei verschiedene Aluminium-Adjuvans-Formulierungen ausgelöst wurden, mit der Menge der induzierten proinflammatorischen Zytokine und der Anzahl der Entzündungszellen an der Injektionsstelle korrelierte.29 Eine Studie an Meerschweinchen zeigt, daß Gardasil von Merck im Vergleich zu Impfstoffen, die mit herkömmlichen Aluminiumadjuvantien adjuvantiert wurden, nekrotische Gewebeschäden und massive Entzündungen verursachte, die über einen Monat nach der Injektion hinaus anhielten.30 Diese Effekte stimmen mit der nachgewiesenen Rolle von schadensassoziierten molekularen Mustern (die Biomarker für Gewebeschäden sind) bei der Förderung der immunverstärkenden Wirkung von Aluminiumadjuvantien überein.31 32 33 34 35
![]()
Bemerkenswert ist, dass Meerschweinchen, denen Gardasil injiziert wurde, einen Monat nach der Injektion auch signifikant erhöhte Werte des Leberschadensmarkers Gamma-Glutamyltransferase aufwiesen.36 In ähnlicher Weise stellten Wang et al.37 fest, dass Mäuse, die mehrere Injektionen des Adjuvans AAHS oder eines an AAHS gebundenen Hepatitis-B-Immunogens erhielten, im Vergleich zu Mäusen, denen Kochsalzlösung injiziert wurde, eine stärkere immunologische Entzündungsreaktion und eine höhere Anzahl nekrotischer Herde in der Leber zeigten. Interessanterweise war die entzündungsfördernde und nekrotische Wirkung von AAHS als alleinigem Wirkstoff größer.38
![]()
Die oben zitierten Forschungsergebnisse bestätigen, dass eine erhöhte Immunpotenz unweigerlich mit einer erhöhten entzündungsbedingten Reaktogenität und einer geringeren Sicherheit einhergeht.39 40 41 42 Dementsprechend wird anerkannt, dass “in Tiermodellen zur Induktion von Autoimmunkrankheiten Entzündungen unerlässlich sind, um die Toleranz gegenüber Selbstantigenen zu überwinden”.43 Das bedeutet, dass starke entzündliche Adjuvantien die notwendigen biochemischen Eigenschaften besitzen, um bei empfänglichen Personen chronische systemische immunvermittelte Krankheiten auszulösen. Es ist daher besorgniserregend, dass AAHS im Vergleich zu herkömmlichen Aluminiumadjuvantien von Merck als der stärkste Auslöser von Antikörperreaktionen nachgewiesen wurde.44
![]()
Die klinischen Studiendaten von Merck deuten darauf hin, dass die systemische Reaktogenität des 4vHPV-Impfstoffs größtenteils auf das Adjuvans AAHS zurückzuführen ist, da ein ähnlicher Prozentsatz an systemischen Wirkungen, einschließlich Kopfschmerzen, Fieber, Übelkeit und Schwindel, sowohl bei Empfängern von Gardasil als auch von AAHS-“Placebo” beobachtet wurde.45 Bei verschiedenen Tierspezies haben Injektionen traditioneller, weniger wirksamer Aluminium-Adjuvantien in Dosen, die für die Exposition des Menschen relevant sind, zu neurophysiologischen Beeinträchtigungen geführt.46 47 48 49 50 51 52 53 54 55 56 57 58
![]()
Darüber hinaus ergab eine Genexpressionsanalyse von Milzlymphozyten, die aus Mäusen isoliert wurden, denen entweder der mit Aluminiumphosphat adjuvantierte Tetanusimpfstoff oder das Adjuvans allein injiziert worden war, dass letzteres viele Marker, die auf systemische Toxizität hindeuten, signifikant hochreguliert, einschließlich mit Entzündungskrankheiten zusammenhängender Gene, Onkogene und Gene, die an Zellstress und Apoptose beteiligt sind.59 Die Tatsache, dass diese Veränderungen in der Milz und weit entfernt von der Injektionsstelle beobachtet wurden, rechtfertigt weitere Untersuchungen zu den systemischen, immunvermittelten Wirkungen von Aluminiumadjuvantien, da sie mit den berichteten Nebenwirkungen beim Menschen in Zusammenhang stehen könnten.60 Neben Reaktionen an der Injektionsstelle wurden Aluminiumadjuvantien insbesondere mit allergischen Reaktionen, Kontaktdermatitis, Kopfschmerzen, Arthralgie, Myalgie, kognitiven Störungen, chronischem Müdigkeitssyndrom, Muskelschwäche und verzögerten Bewegungsabläufen in Verbindung gebracht.61 62 63 64
![]()
Es gibt also keine wissenschaftliche Bestätigung für die Verwendung von Aluminiumadjuvantien als “Placebos” in klinischen Impfstoffversuchen. Wie Gøtzsche et al. argumentierten:
![]()
“Die Verwendung aktiver Vergleichssubstanzen kann es unmöglich machen, schwerwiegende Schäden der HPV-Impfstoffe in den randomisierten Studien zu erkennen, wenn die Vergleichssubstanzen die gleichen oder ähnliche Schäden verursachen.”65
Paradoxerweise werden kochsalzhaltige Placebos routinemäßig in Tierstudien zur Induktion von Autoimmunkrankheiten verwendet, bei denen Aluminium als Adjuvans der Wahl eingesetzt wird, um die Toleranz gegenüber koinjizierten Protein- oder Peptidantigenen zu überwinden.66 67 68 69 Es ist daher höchst problematisch, dass eine Kochsalzlösung als Placebo-Kontrolle in Tierversuchen als Standard für gute Forschung gilt, nicht aber in klinischen Studien mit Menschen.
![]()
3. Mercks Begründung für die Verwendung von AAHS als “Placebo” in klinischen Gardasil-Studien
Um zu ermitteln, wie Merck die Verwendung des Adjuvans AAHS als “Placebo” begründete, trugen Doshi et al. die verfügbaren Informationen zu fünf randomisierten 4vHPV-Gardasil-Impfstoffstudien zusammen, die als “placebokontrolliert” bezeichnet wurden.70 Sie verwendeten sechs Datenquellen: Studienveröffentlichungen, Registereinträge, Zusammenfassungen von klinischen Studienberichten (CSR), CSR-Hauptteile, CSR-Protokolle und Einwilligungserklärungen. Die Ergebnisse zeigten ein hohes Maß an Inkonsistenz bei den Begriffen, die zur Beschreibung des Kontrollarms in allen Studien und Dokumenttypen verwendet wurden. So wurde beispielsweise in den veröffentlichten Zusammenfassungen und Registereinträgen von vier Studien der Kontrollarm nur als “Placebo” oder “vergleichbares Placebo” bezeichnet. Unter den sechs Datenquellen für alle fünf Studien (d. h. insgesamt 30 Dokumente) fanden sich die genauen Informationen über das AAHS-“Placebo” nur in einer CSR-Synopse und zwei CSR-Hauptteilen.
![]()
Insbesondere in den Einwilligungsformularen für zwei Studien gab Merck den Teilnehmern keine Informationen über den Inhalt des Kontrollarms, während Merck in den Formularen für drei andere Studien das “Placebo” mit folgenden Begriffen beschrieb:
![]()
- “Placebo (eine Dosis, die keine aktiven Wirkstoffe enthält)”;
- “Placebo … ein inaktiver Wirkstoff” oder “Placebo … eine inaktive Lösung”; und
- “inaktive Lösung (mit Aluminium 225 µg/Dosis)”.
Wie Doshi et al.71 feststellten, hätte diese Formulierung viele Studienteilnehmer zu dem falschen Schluss verleitet, dass das Placebo keine pharmakologisch wirksamen Bestandteile enthielt.
![]()
Die Begründung für die Verwendung eines aluminiumhaltigen “Placebos” wurde nur in den Studienberichten von drei Studien (V501-012, V501-013 und V501-015) angegeben und lautete wie folgt:
![]()
“Durch den Zusatz von Aluminiumadjuvans sowohl im Impfstoff als auch im Placebo wurde die Verblindung der Studie aufrechterhalten, da Impfstoff und Placebo optisch nicht zu unterscheiden waren.”
“Das Sicherheitsprofil des Aluminiumadjuvans von Merck ist gut charakterisiert. Das Sicherheitsprofil der HPV-6-, -11-, -16- und -18-L1-VLPs hingegen erfordert eine weitere Bewertung am Menschen.”72
Die angegebene Begründung, dass das AAHS-“Placebo” notwendig war, um die Verblindung zu gewährleisten, ist ungenau und wird durch die Tatsache widerlegt, daß Merck in der V501-018 4vHPV-Impfstoffstudie eine Trägerlösung ohne das AAHS-Adjuvans verwendet hat,73 und ein Placebo aus Kochsalzlösung in einer späteren nichtavalenten (9v)HPV-Impfstoffstudie. In Bezug auf die letztgenannte Studie stellten Garland et al. fest:
![]()
“Da der 9vHPV-Impfstoff (eine weißliche, halbdurchsichtige Suspension) und das Kochsalz-Placebo (eine klare, farblose Flüssigkeit) visuell unterscheidbar sind, wurden sie von ausgewiesenem, nicht verblindeten Studienpersonal zubereitet und verabreicht, das nicht anderweitig in die Betreuung und das Management der Studienteilnehmer eingebunden war. Die Integrität der Verblindungsverfahren wurde von ausgewiesenen, nicht verblindeten Mitarbeitern des Sponsors und des Studienzentrums, die in keiner Weise an der Durchführung der Studie beteiligt waren, bewertet.”
“Als Kontrolle wurde ein kochsalzhaltiges Placebo verwendet, was eine Gesamtbeurteilung des Sicherheits-/Verträglichkeitsprofils aller Impfstoffkomponenten, einschließlich der antigenen Proteine und des Adjuvans, ermöglichte”.74
Wenn also, wie Merck selbst zugibt, die Verwendung eines visuell unterscheidbaren Kochsalz-Placebos in einer Studie die Verblindung nicht beeinträchtigte (geschweige denn die Bewertung der Sicherheit des Impfstoffs), dann scheint es keinen legitimen Grund zu geben, warum das gleiche Placebo nicht in allen Gardasil-Studien hätte verwendet werden können.
![]()
In den Protokollen für drei der fünf 4vHPV-Impfstoffstudien beschrieb Merck das “Placebo” als “Standard-Aluminium-Verdünnungsmittel”.75 Es erscheint irreführend, das firmeneigene Adjuvans AAHS, das nur in einer Handvoll von Mercks Impfstoffen verwendet wird, als “Standard-Aluminium-Verdünnungsmittel” zu bezeichnen. Darüber hinaus scheint die Behauptung von Merck, dass “das Sicherheitsprofil von AAHS gut charakterisiert ist”76, wissenschaftlich nicht belegt zu sein. Tatsächlich bedürfen alle klinisch zugelassenen Adjuvantien auf Aluminiumbasis, die derzeit in Human- und Veterinärimpfstoffen verwendet werden, einer weiteren Validierung ihrer Sicherheit.
![]()
4. Sicherheit von Aluminium-Adjuvantien: Was sind die Fakten?
Eine umfassende Überprüfung der vorhandenen Literatur zur Toxikologie von Aluminiumadjuvantien zeigt einen eklatanten Mangel an wissenschaftlichen Daten, die ihre oft behauptete hervorragende Sicherheitsbilanz bestätigen.77 78 79 So identifizierten Masson et al. in einer systematischen Überprüfung und Metaanalyse von Studien aus dem Jahr 2022, die die Biodistribution, Freisetzung und Neurotoxikologie von Aluminiumadjuvantien in Tiermodellen untersuchten, 31 geeignete Studien, von denen sich 17 auf neurotoxikologische Auswirkungen konzentrierten.80 Von diesen 17 Studien zeigten 13 zahlreiche schädliche Wirkungen,81 82 83 84 85 86 87 88 89 90 91 92 93 12 davon imitierten die Exposition von Menschen oder Tierärzten gegenüber Aluminium-Adjuvantien.94 95 96 97 98 99 100 101 102 103 104 105
![]()
Vor allem Studien an Schafen haben gezeigt, dass die Anreicherung von Aluminium im Rückenmark nach der Injektion des Adjuvans allein höher war als nach der Injektion von adjuvantierten Impfstoffen.106 Darüber hinaus zeigten sowohl Tiere, denen Aluminium-adjuvierte Impfstoffe injiziert wurden, als auch solche, denen nur Aluminium injiziert wurde, im Vergleich zu den mit phosphatgepufferter Kochsalzlösung injizierten Kontrolltieren Verhaltensauffälligkeiten,107 wobei letztere Gruppe signifikant stärkere Veränderungen in der Genexpression im Gehirn zeigte.108 Bei diesen Tieren hat Aluminium jene Gene verändert, die mit neurodegenerativen und Autoimmunerkrankungen in Verbindung stehen, sowie Gene, die am Überleben neuronaler Zellen, am mitochondrialen Energiestoffwechsel, an Entzündungsreaktionen, an oxidativem Stress und an der Kontrolle von DNA-Schäden beteiligt sind.109
![]()
Im Gegensatz zu Schafen werden kleine Nagetierarten von den Arzneimittelzulassungsbehörden routinemäßig als irrelevant für die menschliche Immunbiologie abgetan.110 Dennoch argumentieren einige Impfstoffentwickler, dass es einer besseren wissenschaftlichen Erklärung bedarf, warum Daten von Kleintieren, die die Toxizität von Adjuvantien zeigen, für die Verwendung beim Menschen nicht relevant sind.111 [Hervorhebung hinzugefügt]
![]()
Zur Untermauerung dieses Arguments haben zahlreiche Studien gezeigt, dass injizierbares Aluminium (im Gegensatz zu verschlucktem) weder effizient ausgeschieden wird, noch an der Injektionsstelle verbleibt. Vielmehr kann es in entlegene Organe (einschließlich des Gehirns) wandern, wo es sich anreichert, langfristig verbleibt und toxische Wirkungen entfaltet.112 113 114 115 116 117 118 119 120 121 122 123 124 125
![]()
Obwohl Adjuvantien seit über acht Jahrzehnten verwendet werden, ist ihre Sicherheit nach wie vor kaum erforscht. Tatsächlich stellte der Globale Beratende Ausschuss für Impfstoffsicherheit (GACVS) der Weltgesundheitsorganisation (WHO) im Jahr 2004 in Bezug auf die Sicherheit von Adjuvantien fest, dass “dieses bisher vernachlässigte Thema angesichts der modernen Fortschritte bei der Entwicklung und Herstellung von Impfstoffen zunehmend an Bedeutung gewinnt”.126 Auf einer früheren Tagung stellte die GACVS fest, daß “Sicherheitsfragen ein gründliches Verständnis der Auswirkungen von Adjuvantien auf die Immunantwort und die damit verbundenen Mechanismen erfordern … Die Sicherheit von Adjuvantien ist ein wichtiger und vernachlässigter Bereich”.127
![]()
Obwohl sich die Aussagen auf dieser Tagung auf die Forschung und Entwicklung neuer Adjuvantien beziehen, gelten sie gleichermaßen für Aluminiumadjuvantien. Das liegt daran, dass die Art und Weise, wie Aluminiumadjuvantien mit dem Immunsystem interagieren, auch nach fast 100 Jahren ihrer Verwendung immer noch unklar ist.128 129 130 131 132 Aus diesem Grund werden Aluminiumadjuvantien in der zeitgenössischen wissenschaftlichen Literatur manchmal immer noch als das “schmutzige kleine Geheimnis” der Immunologen bezeichnet.133 Dieser griffige Ausdruck wurde von einem der führenden Immunologen des 20. Jahrhunderts, Charles A. Janeway,134 geprägt, der die Mechanismen zu entschlüsseln begann, durch die Adjuvantien die Immunantwort auf fremde Antigene verstärken.135 Es überrascht nicht, dass die Mechanismen der Toxizität von Adjuvantien noch weniger gut verstanden sind als die Mechanismen, durch die Adjuvantien die Immunogenität von Impfstoffen erhöhen.136 Es ist daher verwunderlich, dass die zulässige Aluminiummenge in Humanimpfstoffen ausschließlich auf der Grundlage von Wirksamkeits- und nicht von Sicherheitserwägungen ausgewählt wurde,137 obwohl bekannt ist, dass bei prophylaktischen Impfstoffen, die überwiegend gesunden Personen verabreicht werden, die Sicherheit Vorrang vor der Wirksamkeit haben muss.138 139
![]()
Der Grund, warum die Mechanismen der Toxizität von Adjuvantien nach wie vor schlecht verstanden werden, geht aus den folgenden Erklärungen der weltweit führenden Gesundheitsbehörden und Impfstoffexperten hervor:
![]()
- “In der Vergangenheit wurden bei der nichtklinischen Sicherheitsbewertung von Präventivimpfstoffen häufig keine Toxizitätsstudien an Tiermodellen durchgeführt, da Impfstoffe nicht als inhärent toxisch angesehen wurden”;140
- Pharmakokinetik/Biodistribution, Immunotoxizität, Karzinogenität und Genotoxizität sind für Impfstoffformulierungen, die vorhandene Aluminiumadjuvantien enthalten, nicht erforderlich; 141 142 143
- obwohl bei der präklinischen Sicherheitsprüfung von Adjuvantien nicht auf Tiere verzichtet werden kann und ungeachtet der bisherigen bedeutenden Fortschritte in diesem Forschungsbereich gibt es derzeit keine validierten Tiermodelle, die die immuntoxikologischen Risiken von Adjuvantien, die für den menschlichen Gebrauch bestimmt sind, genau vorhersagen können. 144 145 146
Dementsprechend haben die Impfstoffentwickler eingeräumt, dass “derzeit nicht bekannt ist, welche Arten von präklinischen Tests geeignet wären, um festzustellen, ob ein Adjuvans immunologisch sicher ist oder nicht” (d. h. ob es bei empfänglichen Personen eine Immunkrankheit auslösen oder verschlimmern kann).147 Aus diesen Aussagen geht hervor, daß noch erhebliche Hürden zu überwinden sind, bevor die Sicherheit bestehender und neuer Adjuvantien angemessen bewertet werden kann. Die häufig zu hörende Behauptung, Aluminiumadjuvantien hätten eine lange “etablierte” und “nachgewiesene” Sicherheitsbilanz,148 149 150 ist daher nicht haltbar.
![]()
5. Informierte Zustimmung in der FUTURE-II-Studie von Merck zu Gardasil in Dänemark
Die FUTURE-II-Studie (V501-015) war Mercks größte klinische Gardasil-Studie, bei der das “Placebo” das Adjuvans AAHS enthielt (Tabelle 1). In der dänischen Studie wurden die Teilnehmer nicht über das AAHS im “Placebo” informiert; stattdessen hieß es in der Einwilligungserklärung und in der Rekrutierungsbroschüre, dass es sich bei dem “Placebo” entweder um einen Impfstoff ohne Wirkstoff oder um Kochsalzlösung handelte.151
![]()
Wie in Abb. 1 dargestellt, besagt die Schlüsselstelle in der Einwilligungserklärung: “Die eine Hälfte der Teilnehmer erhält den aktiven Impfstoff, die andere Hälfte den Placebo-Impfstoff (d. h. einen Impfstoff ohne aktive Substanz)”. Abb. 2 zeigt die Anzeige von Merck, in der die potenziellen Teilnehmer darüber informiert werden, dass sie ein Kochsalz-Placebo (“saltvand”) erhalten würden. Im Gegensatz dazu wurde im Studienprotokoll erklärt, dass das “Placebo” AAHS enthielt, so dass die Prüfer im Gegensatz zu den Studienteilnehmern wussten, dass es sich bei der Kontrolle nicht um Kochsalzlösung handelte.152 153
![]()


Es sei darauf hingewiesen, dass die dänische Arzneimittelbehörde und das dänische Nationale Ethikkomitee für Gesundheitsforschung widersprüchliche Informationen über das “Placebo” in der FUTURE-II-Studie erhielten, da ihnen das Studienprotokoll vorgelegt wurde, in dem es hieß, das “Placebo” enthalte das Aluminium-Adjuvans, während in der Rekrutierungsbroschüre und der Einverständniserklärung angegeben wurde, das “Placebo” enthalte Kochsalzlösung.154 Darüber hinaus erklärte Merck in der Rekrutierungsbroschüre, daß FUTURE II “KEINE Nebenwirkungsstudie” sei und daß der HPV-Impfstoff abgesehen von einer leichten Rötung und Wundsein an der Injektionsstelle keine Nebenwirkungen habe (Abb. 3). Im Protokoll der klinischen Studie heißt es jedoch, dass die Sicherheitsprüfung eines der Hauptziele der Studie war. Daher schien auch in diesem Fall die informierte Zustimmung nicht gewährleistet zu sein, da die einwilligenden Teilnehmer fälschlicherweise darüber informiert wurden, dass sich der HPV-Impfstoff bereits als sicher erwiesen habe.155
![]()

Wir haben einen umfangreichen Schriftverkehr mit Ärzten geführt, die Patienten mit Verdacht auf schwere Impfschäden nach der HPV-Impfung behandeln, in dem auch sechs Teilnehmer der FUTURE-II-Studie besprochen wurden. Wir haben auch einige dieser Patienten befragt und festgestellt, dass drei der sechs Patienten, die nach dem Zufallsprinzip in die “Placebo”-Gruppe eingeteilt wurden und drei Dosen AAHS erhielten, nach der Studie drei Dosen Gardasil erhielten. Diese drei Teilnehmer erhielten also unwissentlich sechs AAHS-Dosen. Mindestens zwei der Teilnehmer erhielten die in Abb. 2 und 3 gezeigte Rekrutierungsbroschüre. Obwohl alle sechs Mädchen während der Studie ähnliche Symptome aufwiesen, die sie außer Gefecht setzten, wurden die Symptome von den klinischen Prüfern von Merck als nicht mit dem Impfstoff zusammenhängend abgetan. In Übereinstimmung mit dem Bericht von Sørensen und Andersen156 erfuhren viele auch eine Stigmatisierung durch ihre Hausärzte, die ihre Symptome ebenfalls herunterspielten und sie in einigen Fällen als Hypochonder abstempelten.
![]()
Das Problem komplexer Erkrankungen mit neurologischen und dysautonomen Faktoren im Zusammenhang mit Gardasil ist nicht auf Dänemark beschränkt. Die Neuartigkeit des angeblich durch die HPV-Impfung ausgelösten Syndroms führte jedoch zu Schwierigkeiten bei der Klassifizierung und Identifizierung weltweit. Ähnliche Kombinationen von Symptomen haben je nach Land zu unterschiedlichen Diagnosen geführt, wodurch das potenzielle Sicherheitssignal verwässert wird.157 Zu den häufigsten Diagnosen gehören das posturale orthostatische Tachykardiesyndrom [POTS], das chronische Müdigkeitssyndrom, das komplexe regionale Schmerzsyndrom [CRPS], die Fibromyalgie und die Small-Fiber-Neuropathie.158 159 160 161 162 163 164 165 166 167 168 169 170 171 172 173
![]()
In Japan wurde das “Human Papillomavirus Vaccination Associated Neuroimmunopathic Syndrome” (HANS) als diagnostischer Begriff für das mutmaßlich durch die HPV-Impfung ausgelöste Syndrom vorgeschlagen.174 In Anbetracht der Tatsache, dass HPV-Impfstoffe eine einzigartige Kombination aus wirksamen Aluminium-Adjuvans-Formulierungen und hoch immunogenen virusähnlichen Partikeln mit vielen Peptidsequenzen enthalten, die denen menschlicher Antigene ähneln,175 176 177 178 ist es nicht unplausibel, dass sie eine Vielzahl von schwer zu diagnostizierenden immunologischen Entzündungserscheinungen hervorrufen können.
![]()
6. Widersprüchliche Angaben der Zulassungsbehörden sowie von Merck zur Zusammensetzung und Sicherheit von AAHS
Laut der Europäischen Arzneimittelagentur (EMA)
![]()
“wurde bei der Entwicklung beider Impfstoffe die Verwendung von Al(OH)3 (500 μg) anstelle eines echten Placebos (inaktive Kontrolle) vom CHMP [Ausschuss für Humanarzneimittel] für akzeptabel befunden, um die doppelte Verblindung der Studien und damit die Validität der Daten aufrechtzuerhalten … Der für beide Impfstoffe gewählte Ansatz wurde vom CHMP [Ausschuss für Humanarzneimittel] als zuverlässiger Weg zur Erstellung des Sicherheitsprofils der Impfstoffe zum Zeitpunkt der Zulassung angesehen”.179 [Hervorhebung hinzugefügt]
In dieser Erklärung gab die EMA offenbar zu, dass ein Aluminium-Adjuvans kein echtes Placebo ist. Darüber hinaus übernahm die Agentur unkritisch die von Merck angeführte Begründung für die Verwendung eines Schein-Placebos, um die Verblindung aufrechtzuerhalten,180 und führte aus:
![]()
“In der Tat hätte ein inaktives Placebo nur eine geringe lokale Reaktogenität hervorgerufen … Da das Kontrollprodukt die gleiche Menge an Al(OH)3 wie der Studienimpfstoff enthielt, induzierte es ein gewisses Maß an lokalen Reaktionen, die es den Probanden oder dem Studienpersonal nicht ermöglicht hätten, ohne weiteres zu unterscheiden, ob ein HPV-Impfstoff oder eine Kontrolle verabreicht wurde”.181 [Hervorhebung hinzugefügt]
Da die EMA einräumt, dass eine Aluminiumformulierung im Vergleich zu einem echten inerten Placebo eine stärkere Reaktogenität hervorruft (die allerdings systemisch und nicht nur “lokal” sein kann182 183 ), folgt daraus, dass Studien mit Aluminium-“Placebos” nicht – wie die Agentur behauptet – “ein zuverlässiger Weg sind, um das Sicherheitsprofil der Impfstoffe zu ermitteln”.184
![]()
Wie das Nordic Cochrane Centre feststellte, sind die wichtigsten Ergebnisse der HPV-Impfstoffstudien die Veränderungen der Gebärmutterhalszellen, deren Bewertung in der Routinepraxis höchstwahrscheinlich nicht durch die fehlende Verblindung viele Jahre zuvor, als die Kinder geimpft wurden, beeinflusst wird. Die angebliche Notwendigkeit, die Verblindung aufrechtzuerhalten, während gleichzeitig die Möglichkeit verloren geht, die mit dem Impfstoff verbundenen Schäden angemessen zu untersuchen, wirft daher berechtigte Bedenken hinsichtlich der wissenschaftlichen und ethischen Standards sowohl der EMA als auch der Impfstoffhersteller auf.185 186 Die Inkonsequenz von Merck in diesem Zusammenhang wird aus der Tatsache ersichtlich, dass laut ihrem eigenen Handbuch “die Verabreichung einer aktiven Behandlung allein aufgrund eines Placebo-Effekts als unethisch angesehen werden kann, da sie die Patienten tatsächlichen unerwünschten Wirkungen aussetzt”.187 [Hervorhebung hinzugefügt]
![]()
Wir stellen ferner fest, dass entgegen der oben zitierten Aussage der EMA “das Kontrollprodukt” in den Gardasil-Impfstoffstudien nicht “dieselbe Menge an Al(OH)3 wie der Studienimpfstoff” enthielt, da es sich bei dem Adjuvans in Gardasil um AAHS und nicht um Al(OH)3 handelt. Der Grund für die Verwechslung von AAHS mit Aluminiumhydroxid wird in der Aussage der EMA zu Mercks AAHS-adjuvantem Impfstoff Procomvax deutlich, den die Agentur 2004 zugelassen hat. Der EMA zufolge ist
![]()
“das Adjuvans AAHS [in Procomvax] die gleiche chemische Verbindung wie die ursprünglich als ‘Aluminiumhydroxid’ bezeichnete, die in den Studien verwendet wurde, die zur ursprünglichen Zulassung führten … Die Namensänderung spiegelt eine Änderung der Nomenklatur wider, die nach der ursprünglichen Zulassung von Procomvax erfolgte”.188
AAHS ist jedoch nicht die gleiche chemische Verbindung wie Aluminiumoxid (fälschlicherweise als “Aluminiumhydroxid” bezeichnet). Diese beiden Adjuvantien haben völlig unterschiedliche physikalisch-chemische Eigenschaften189 und ihre Bezeichnungen sind daher nicht austauschbar. Die Studie von Merck selbst bestätigt diese Tatsache.190
![]()
Nichtsdestotrotz war es Merck, das AAHS ursprünglich fälschlicherweise mit Aluminiumoxidhydroxid gleichsetzte, denn während der Erneuerung der Zulassung von Procomvax im Jahr 2004 schlug Merck der EMA vor, “die Bezeichnung des Hilfsstoffs Aluminiumhydroxid durch amorphes Aluminiumhydroxyphosphatsulfat zu ersetzen”. Diese Änderung wurde offenbar von Merck beantragt, um “die Nomenklatur des Hilfsstoffs in allen relevanten, zu diesem Zeitpunkt zugelassenen Merck-Impfstoffen anzugleichen”.191 In der ursprünglichen Produktinformation von Procomvax aus dem Jahr 1999 wird “Aluminiumhydroxid” als Adjuvans-Bestandteil von Procomvax aufgeführt,192 während in der Version von 2004 AAHS genannt wird.193
![]()
Die 2010 veröffentlichte Packungsbeilage desselben Impfstoffs, der in den USA 1996 unter dem Namen Comvax zugelassen wurde, ist transparenter, da dort angegeben wird, dass die antigene Komponente des Impfstoffs “an ein amorphes Aluminiumhydroxyphosphatsulfat-Adjuvans (früher als Aluminiumhydroxid bezeichnet) adsorbiert ist”.194 [Hervorhebung hinzugefügt] In ähnlicher Weise heißt es in der Packungsbeilage 2010 eines anderen AAHS-adjuvierten Impfstoffs, der vor Gardasil zugelassen wurde:
![]()
“Jede 0,5-ml-Dosis von flüssigem PedvaxHIB ist … so formuliert, dass sie … 225 µg Aluminium als amorphes Aluminiumhydroxyphosphatsulfat (früher als Aluminiumhydroxid bezeichnet) enthält …”.195 [Hervorhebung hinzugefügt]
In der Veröffentlichung einer klinischen Studie aus dem Jahr 1991, die zur Zulassung von Pedvax durch die US-amerikanische Food and Drug Administration (FDA) führte,196 heißt es, dass der Impfstoff mit einem Aluminiumhydroxid-Verdünnungsmittel neu zusammengesetzt wurde.197
![]()
Wie in früheren Fällen wird in der Packungsbeilage des ersten zugelassenen AAHS-Impfstoffs von Merck, Recombivax, aus 2018 angegeben, dass alle Formulierungen dieses Impfstoffs “etwa 0,5 mg Aluminium (in Form von amorphem Aluminiumhydroxyphosphatsulfat, früher als Aluminiumhydroxid bezeichnet) enthalten…”198 [Hervorhebung hinzugefügt]. In Übereinstimmung damit führen sowohl die Zusammenfassung der Zulassungsgrundlagen für Recombivax aus dem Jahr 1987,199 als auch die Aktualisierung zur Hepatitis-B-Prävention von 1987 der U.S. Centers for Disease Control and Prevention (CDC) Advisory Committee on Immunization Practices (ACIP) “Aluminiumhydroxid” als Adjuvans in Recombivax auf;200 wohingegen aktuelle, vom National Institute of Health (NIH) betreute Internetquellen zeigen, dass AAHS das Adjuvans war, das 1986 als Bestandteil von Recombivax zugelassen wurde.201 202
![]()
In einem Artikel aus dem Jahr 2002 mit dem Titel “Aluminum salts in vaccines-US perspective” (Aluminiumsalze in Impfstoffen – eine amerikanische Sichtweise) wird der Adjuvansbestandteil aller AAHS-haltigen Impfstoffe von Merck, die vor Gardasil zugelassen waren – Recombivax, Pedvax, Comvax und Vaqta – als Aluminiumhydroxid aufgeführt.203 Die Autoren dieses Artikels waren Norman W. Baylor, der damals Direktor des Office of Vaccines Research and Review (OVRR) im Center for Biologics Evaluation and Research (CBER) war, und seine beiden Kollegen aus derselben Behörde.
![]()
Es hat daher den Anschein, dass Mercks firmeneigenes Adjuvans AAHS erstmals 1986, also 20 Jahre vor der Zulassung von Gardasil, unter der falschen Bezeichnung “Aluminiumhydroxid” als Bestandteil eines pädiatrischen Hepatitis-B-Impfstoffs zugelassen wurde, der als erste von drei Impfdosen nach der Geburt verabreicht wird.204 205 206 Die Schlüsselfrage lautet: Warum hat Merck AAHS jemals als “Aluminiumhydroxid” bezeichnet? Und wie kann Merck in einem solchen Fall behaupten, die Sicherheit von AAHS sei “gut charakterisiert”, wenn die ersten Impfstoffe, in denen AAHS als Adjuvans verwendet wurde, sowohl den amerikanischen als auch den europäischen Aufsichtsbehörden gegenüber als “Aluminiumhydroxid” bezeichnet wurden?
![]()
Wenn die Sicherheit von AAHS gut charakterisiert war und Merck über solide Daten verfügte, warum hat Merck dann nicht offengelegt, dass es AAHS in Impfstoffen vor Gardasil verwendet hatte, sondern den Aufsichtsbehörden gegenüber fälschlicherweise angegeben, dass es sich bei dem Adjuvans um “Aluminiumhydroxid” handelte? Eine Offenlegung der Tatsache, dass Merck ein neuartiges, patentrechtlich geschütztes Adjuvans verwendet hat, hätte eine Aufforderung der Aufsichtsbehörden zu zusätzlichen Sicherheitsstudien nach sich ziehen können. Der EMA zufolge wurden nämlich “toxikologische Studien zu AAHS allein nicht durchgeführt, da dieses Adjuvans bereits in mehreren anderen Impfstoffen von Merck verwendet wurde und ein etabliertes Sicherheitsprofil aufweist”.207
![]()
Hätte Merck der EMA jedoch erst 2004 mitgeteilt, dass AAHS in Procomvax verwendet wurde, hätte die EMA diese früheren Impfstoffe in der irrigen Annahme zugelassen, dass es sich bei der Adjuvans-Komponente um Aluminiumhydroxid und nicht um AAHS handelte. Das Gleiche gilt für die US-amerikanische FDA, denn noch im Jahr 2002, wie aus dem Artikel von Baylor et al. hervorgeht,208 hatte die CBER offenbar den falschen Eindruck, dass die von der Behörde zugelassenen Impfstoffe von Merck – Recombivax, Pedvax, Comvax und Vaqta – mit Aluminiumhydroxid adjuvantiert waren. Aus öffentlich zugänglichen Dokumenten geht weder hervor, wann Merck der FDA mitteilte, dass es sich bei dem Adjuvans in all diesen Impfstoffen tatsächlich um AAHS handelte, noch wie die FDA auf diese Mitteilung reagierte.
![]()
Wir stellen ferner fest, dass die klinische Sicherheitsbewertung, die zur Zulassung dieser Impfstoffe führte, sehr begrenzt war. So heißt es beispielsweise in der Packungsbeilage von Recombivax:
![]()
“In drei klinischen Studien wurden 434 Dosen Recombivax, 5 µg, an 147 gesunde Säuglinge und Kinder verabreicht …, die nach jeder Dosis fünf Tage lang überwacht wurden … In einer Gruppe von Studien wurden 3258 Dosen Recombivax HB, 10 µg, an 1252 gesunde Erwachsene verabreicht, die nach jeder Dosis fünf Tage lang überwacht wurden”.209
In einer wichtigen klinischen Studie vor der Zulassung von Pedvax, bei der 2056 Säuglinge die zweite Dosis des Impfstoffs und 2105 das Placebo erhielten, betrug die Sicherheitsüberwachung für schwerwiegende unerwünschte Ereignisse 30 Tage,210 was immer noch unzureichend ist, um Autoimmunereignisse mit schleichendem Beginn zu erkennen, die sich erst nach vielen Monaten manifestieren können.211 212 Interessanterweise enthielt das Placebo in dieser Studie 2 mg Laktose, wodurch sichergestellt wurde, dass “das Aussehen des Impfstoffs und des Placebos identisch waren”, um die Verblindung zu wahren.213 Die klinische Studie von Merck zu Pedvax, die den Gardasil-Studien vorausging, zeigt also eindeutig, dass es nie notwendig war, ein Aluminium-Adjuvans zur Verblindung zu verwenden.
![]()
In einer späteren Schlüsselstudie, die zur Zulassung des Hepatitis-A-Impfstoffs Vaqta führte, verwendete Merck jedoch ein Aluminium-“Placebo”. In dieser Studie, die auch als Monroe-Wirksamkeitsstudie bekannt ist, erhielten insgesamt 519 gesunde Kinder und Jugendliche im Alter von 2 bis 16 Jahren den Impfstoff und 518 das Aluminium-“Placebo”-Verdünnungsmittel.214 215 216 Die 1992 veröffentlichte Monroe-Studie besagt, dass der Impfstoff “an Aluminiumhydroxid adsorbiert” war und “wie der Impfstoff, jede Dosis des Placebos – Aluminiumhydroxid-Verdünnungsmittel – 300 μg Aluminium enthielt”.217 Seite 7 der Packungsbeilage offenbart jedoch, dass das in der Monroe-Studie verwendete Aluminium-“Placebo”-Verdünnungsmittel in Wirklichkeit “amorphes Aluminiumhydroxyphosphatsulfat” war.218 (Abb. 4)
![]()
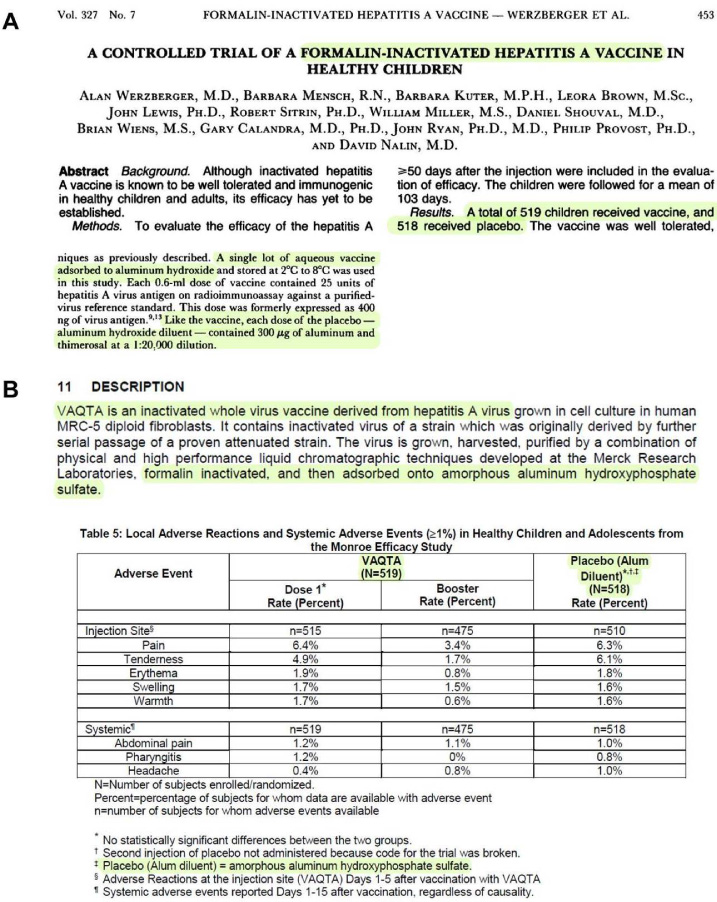
Es scheint also, dass die Gardasil-Studien nicht die ersten klinischen Studien waren, bei denen Merck AAHS als “Placebo” verwendete. Es hat auch den Anschein, dass die Gardasil-Studien nicht die ersten Studien waren, bei denen Merck keine Transparenz in Bezug auf die Zusammensetzung des Placebos zeigte, da aus den zitierten Unterlagen hervorgeht, dass AAHS zum Zeitpunkt dieser Studien – d. h. “zuvor” – als “Aluminiumhydroxid” bezeichnet wurde. Darüber hinaus wurden offenbar sowohl die amerikanischen als auch die europäischen Zulassungsbehörden von Merck zu der Annahme verleitet, dass es sich bei dem Adjuvans, das in den vor Gardasil zugelassenen Impfstoffen mehrerer Hersteller verwendet wurde, nicht um eine neuartige Aluminiumverbindung handelte, sondern um eines der herkömmlichen Aluminiumadjuvantien, die seit vielen Jahrzehnten in Humanimpfstoffen verwendet werden.
![]()
Doch selbst wenn die Überwachung nach dem Inverkehrbringen ergeben würde, dass es keine nennenswerten Sicherheitsprobleme mit AAHS-adjuvierten Impfstoffen aus der Zeit vor Gardasil gibt (was nach Ansicht der EMA der Fall ist221 ), wäre es dennoch falsch, daraus zu schließen, dass alle AAHS-adjuvierten Impfstoffformulierungen gleichermaßen sicher sind. Nach den WHO-Leitlinien zur nichtklinischen Bewertung von Adjuvantien und adjuvantierten Impfstoffen können einzelne Antigene in ihren immunogenen Eigenschaften variieren. Aus diesem Grund kann eine durch Adjuvans vermittelte Verstärkung der Immunantwort auf ein Impfstoffantigen nicht auf ein anderes Antigen extrapoliert werden.222
![]()
Die Impfstoffhersteller haben ebenfalls bekräftigt, dass “es nicht akzeptabel erscheint, die Reaktogenität eines Adjuvans in einer bestimmten Antigen-/Adjuvans-Formulierung auf eine andere zu extrapolieren”, da für ein bestimmtes Adjuvans uneinheitliche Reaktogenitätsmuster beobachtet wurden, wenn es mit verschiedenen Antigenen kombiniert wurde.223 Trotzdem erklärte die EMA in Bezug auf Mercks AAHS, dass aufgrund der Verwendung dieses Adjuvans in anderen Merck-Impfstoffen, die zuvor von der Agentur mit einem akzeptablen Wirksamkeits- und Sicherheitsprofil zugelassen worden waren, keine Sicherheitsbedenken in Bezug auf seine Verwendung im Gardasil-Impfstoff bestünden.224
![]()
An anderer Stelle scheint die EMA anzuerkennen, dass die AAHS-induzierte Immunreaktion ein Risiko für Autoimmunität darstellen könnte. Insbesondere in einem Bericht aus dem Jahr 2015, der die Ergebnisse der Studie zur Toxizität des 9vHPV-Impfstoffs von Merck mit wiederholter Verabreichung an Sprague-Dawley-Ratten zusammenfasst, stellte die EMA fest:
![]()
“Die in den drainierenden Lymphknoten beobachteten Veränderungen waren in den Gruppen mit Adjuvans und Placebo ähnlich häufig und schwerwiegend wie in den Gruppen mit hochdosiertem Impfstoff und wurden als sekundär zur Stimulierung des Immunsystems durch das Adjuvans angesehen … Theoretisch könnte die stimulierende Wirkung auf die Lymphoide … Autoimmunkrankheiten verursachen/verschlimmern, aber ein solches Risiko kann nur in der Post-Marketing-Einstellung beim Menschen charakterisiert werden”.225 [Hervorhebung hinzugefügt]
Die in der Gardasil-Packungsbeilage zusammengefassten Ergebnisse der Gardasil-Studien zeigen, dass das Auftreten “neuer medizinischer Zustände”, die auf eine Autoimmunerkrankung hindeuten, bei Impfstoff- und AAHS-Empfängerinnen gleich war (2,3%).226 Anstatt jedoch als Garantie für die Sicherheit von Gardasil interpretiert zu werden, könnten diese Ergebnisse angesichts des zitierten Eingeständnisses der EMA auf ein mögliches Autoimmunrisikosignal hindeuten, das auf die stark immunstimulierende Adjuvans-Komponente des Impfstoffs zurückzuführen ist.
![]()
Im Jahr 2019 bestätigte die EMA die Sicherheit von Impfstoffen mit Aluminiumadjuvans, indem sie feststellte, dass
![]()
“die Sicherheitsdaten, die im Laufe von sechs Jahrzehnten bei der Verwendung von aluminiumhaltigen Impfstoffen gesammelt wurden, gezeigt haben, dass ihr Sicherheitsprofil akzeptabel ist und nur lokale Reaktionen als mögliche Nebenwirkung im Zusammenhang mit Aluminium auftreten, die normalerweise innerhalb eines kurzen Zeitraums abklingen … Für die Marktzulassung sind keine neuen klinischen Sicherheitsstudien erforderlich, in denen Aluminium allein mit einer inaktiven Kontrolle verglichen wird”.227 [Hervorhebung hinzugefügt]
Dementsprechend stellte die EMA im Jahr 2016 fest:
![]()
“Die Sicherheit des Aluminium-Adjuvans gilt als gut charakterisiert … Darüber hinaus ergaben nicht-klinische Studien für HPV-Impfstoffe, wie etwa konventionelle Studien zur Sicherheitspharmakologie, akuten Toxizität und Toxizität bei wiederholter Verabreichung … kein potenzielles Risiko für den Menschen“.228 [Hervorhebung hinzugefügt]
Abgesehen davon, dass sie damit ihrer früheren Feststellung widerspricht, dass ein theoretisches (d. h. potenzielles) Risiko besteht, dass AAHS Autoimmunkrankheiten verursacht oder verschlimmert,229 ist es beunruhigend, dass die EMA in diesem Fall fast wörtlich die Aussage von Merck über das Sicherheitsprofil des “Aluminium-Adjuvans” als “gut charakterisiert” wiederholt.230
![]()
Eine weitere eklatante Ungereimtheit besteht darin, dass obwohl Impfstoffadjuvantien aus immunologischer Sicht als aktive Bestandteile einer Impfstoffformulierung anerkannt und angesehen werden, sie für regulatorische Zwecke sowohl von der amerikanischen FDA als auch von der EMA als inaktive Bestandteile oder Hilfsstoffe betrachtet werden.231 232 Da eine solche inhärent unlogische Position nicht evidenzbasiert sein kann, muss der Grund dafür an anderer Stelle gesucht werden. In einem Bericht aus dem Jahr 2013 über einen Workshop zu adjuvantierten Impfstoffen, an dem Wissenschaftler aus Hochschulen, Zulassungsbehörden und der Impfstoffindustrie teilnahmen, heißt es:
![]()
“Wenn Adjuvantien aus regulatorischer Sicht als Wirkstoffe betrachtet würden, wären klinische Studien erforderlich, in denen nachgewiesen wird, dass jeder Wirkstoff in der Impfstoffformulierung zu der behaupteten Wirkung beiträgt. Dies könnte den Umfang und die Kosten der klinischen Versuche erheblich erhöhen. Würden sie als Hilfsstoffe betrachtet, wären solche klinischen Studien nicht erforderlich”.233
Es scheint also, dass der Grund, warum die Regulierungsbehörden Adjuvantien als “inaktive” Bestandteile betrachten, darin liegt, den Impfstoffherstellern die Kosten und logistischen Hürden zu ersparen, die mit der Durchführung größerer klinischer Studien verbunden sind. Was diese Situation noch bizarrer macht, ist die Tatsache, dass die WHO Folgendes einräumt:
![]()
“Da Adjuvantien ihre eigenen pharmakologischen Eigenschaften haben, die sowohl die Immunogenität als auch die Sicherheit von Impfstoffen beeinflussen können, ist eine Sicherheitsbewertung unerlässlich.”234
“Kurz- und langfristige Sicherheitsbewertung und -vorhersage sind wichtig, ebenso wie die Bewertung der Pharmakokinetik des Adjuvans allein.”235 [Hervorhebung hinzugefügt]
In ähnlicher Weise bekräftigte die EMA in Abschnitt 4.3 der Leitlinien von 2004 über Adjuvantien in Humanimpfstoffen, dass “das Adjuvans allein getestet werden sollte”236 [Hervorhebung hinzugefügt]. Während der Diskussion über HPV-Impfstoffe auf der ACIP-Tagung der CDC in den USA am 24. und 25. Oktober 2007 bemerkte ein ACIP-Mitglied (Franklyn Judson), dass
![]()
“die jahrelangen Erfahrungen mit Hepatitis-B- und anderen Protein-/Aluminium-Kombinationen darauf hindeuten, dass der reaktogene Teil überwiegend das Aluminium ist und dass Studien, bei denen Aluminium ohne das aktive Protein verwendet wird, in Bezug auf die Reaktogenität nicht wirklich Placebos sind”.
Angesichts dieser Aussagen ist es schwer zu verstehen, warum Impfstoffhersteller immer noch Aluminiumadjuvantien als “Placebos” in klinischen Impfstoffstudien verwenden dürfen.
![]()
7. Risiken und Nutzen der HPV-Impfstoffe
In einer systematischen Übersichtsarbeit aus dem Jahr 2020 mit Meta-Analysen von Daten aus klinischen Studien zu den HPV-Impfstoffen Gardasil von Merck und Cervarix von GlaxoSmithKline kamen Jørgensen et al.237 zu dem Ergebnis, dass die HPV-Impfstoffe nach einer Nachbeobachtungszeit von vier Jahren zu einer Verringerung von HPV-bedingten Karzinomen in situ, äußeren Genitalverletzungen und HPV-bedingten Behandlungsverfahren führten. Die HPV-Impfstoffe führten jedoch zu einer Zunahme schwerer Störungen des Nervensystems und allgemeiner Schäden. Jørgensen et al.238 stuften alle 24 von ihnen untersuchten Studien aus folgenden Gründen als hochgradig biasgefährdet ein:
![]()
- 99% der Studienteilnehmer erhielten einen aktiven Vergleichsstoff, der die Adjuvans-Komponente der Studienimpfstoffe enthielt;
- Obwohl die Impfstoffhersteller Aluminiumadjuvanzien als sicher einstufen, wurden 52% der Teilnehmer nur dann in die Studien aufgenommen, wenn sie zuvor noch nie die Studienadjuvanzien erhalten hatten;
- Zwei Drittel der Teilnehmer wurden nur dann in die Studien aufgenommen, wenn sie in der Vorgeschichte keine Störungen des Immunsystems oder des Nervensystems aufwiesen, obwohl solche Erkrankungen in den aktuellen Packungsbeilagen der HPV-Impfstoffe nicht als Warnhinweise oder Kontraindikationen aufgeführt sind;
- Schwerwiegende unerwünschte Wirkungen wurden bei 72% der Studienteilnehmer unvollständig gemeldet (alle 24 CSRs enthielten Schwärzungen – insbesondere von Schäden – und es fehlten Teile wie Berichte über schwerwiegende Schäden und Fallberichtsformulare);
- Schwerwiegende unerwünschte Wirkungen wurden in den klinischen Studien von Merck nur bis zu 14 Tage nach jeder Gardasil-Injektion erfasst; darüber hinaus wurden schwerwiegende unerwünschte Wirkungen nur dann erfasst, wenn sie nach Einschätzung der Studienleiter mit der Injektion in Zusammenhang standen;
- Eine längere Nachbeobachtung war bei 7% der “Placebo”-Empfänger nicht möglich, da ihnen bei Abschluss der Studie eine HPV-Impfung angeboten wurde.
Die Autoren kamen zu dem Schluss, dass die untersuchten Studien in erster Linie auf die Bewertung des Nutzens ausgerichtet waren und nicht angemessen auf die Beurteilung des Schadens, so dass unklar ist, inwieweit der Nutzen der HPV-Impfstoffe ihre schädlichen Auswirkungen überwiegt.239
![]()
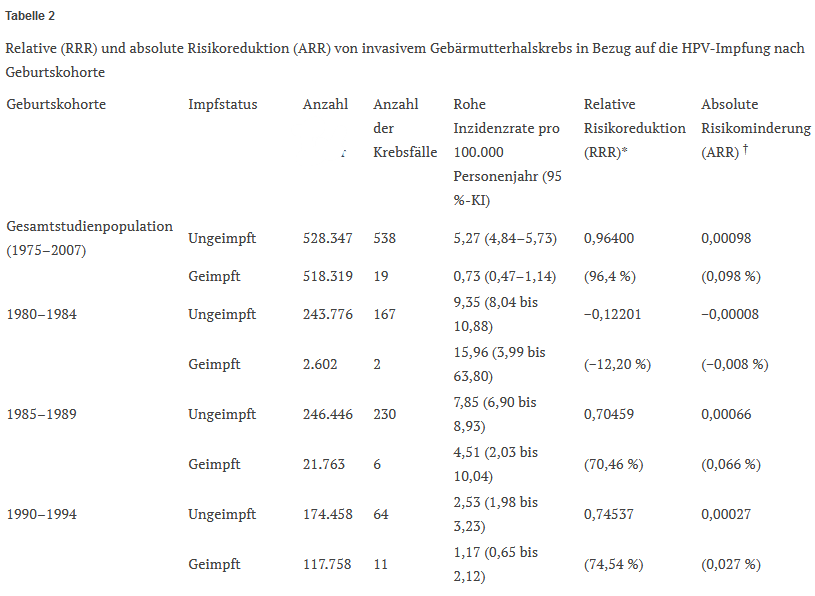
Die bisher am häufigsten zitierte Studie, die angeblich eine signifikante Verringerung des invasiven Gebärmutterhalskrebses bei Gardasil-Empfängerinnen belegt, umfasste 528.347 ungeimpfte und 518.319 geimpfte schwedische Mädchen und junge Frauen im Alter von 10 bis 30 Jahren.240 Während des Studienzeitraums wurde bei 538 Frauen, die nicht mit Gardasil geimpft worden waren, Gebärmutterhalskrebs diagnostiziert, im Vergleich zu nur 19 geimpften Frauen (bereinigtes Inzidenzratenverhältnis (IRR) 0,37, 95% CI 0,21-0,57). Die vollständig bereinigte IRR für Gebärmutterhalskrebs bei Frauen, die vor ihrem 17. Lebensjahr geimpft wurden, betrug 0,12 (95% CI 0,00-0,34). Diese Ergebnisse wurden in der Presse als Beleg für eine fast 90-prozentige Verringerung der Inzidenz von invasivem Gebärmutterhalskrebs bei Mädchen, die vor dem Alter von 17 Jahren geimpft wurden, gefeiert.241
![]()
Wenn jedoch die überragende Verringerung des relativen Risikos für invasiven Gebärmutterhalskrebs (96,4% für die gesamte Studienpopulation, Tabelle 2) in eine Verringerung des absoluten Risikos (0,098%, Tabelle 2) umgerechnet wird, ist der Nutzen der HPV-Impfung im Hinblick auf die Auswirkungen auf die öffentliche Gesundheit praktisch vernachlässigbar. Die Zahlen zur absoluten Risikoreduktion, die nach Geburtskohorten geschichtet sind, sind noch weniger beeindruckend und reichen von negativen 0,008% für die ältere Geburtskohorte 1980-1984 bis zu 0,027% für die jüngere Geburtskohorte 1990-1994 (Tabelle 2).
![]()
Bemerkenswert ist, dass die Rate der schwerwiegenden unerwünschten Wirkungen in der größten klinischen Gardasil-Studie vor der Zulassung – der FUTURE-II-Studie – bei 0,7% lag, von denen weniger als 0,1% von den von Merck gesponserten Prüfärzten als impfstoffbedingt eingestuft wurden.242 Wenn man bedenkt, dass die Rate schwerwiegender unerwünschter Wirkungen unter realen Bedingungen viel höher sein wird, weil auch Personen mit bereits bestehenden Erkrankungen geimpft werden, die von den klinischen Gardasil-Studien ausgeschlossen wurden, scheint das Nutzen-Risiko-Verhältnis der Gardasil-Impfung in den Industrieländern nicht so überwältigend zu sein, wie von den Gesundheitsbehörden behauptet.243 Denn in den Industrieländern, in denen die Gebärmutterhalskrebsvorsorge gut etabliert ist, ist die Inzidenz von Gebärmutterhalskrebs sehr niedrig (4,9-6,9/100.000244 ). Darüber hinaus muß das regelmäßige Gebärmutterhals-Screening beibehalten werden, da die derzeit zugelassenen HPV-Impfstoffe nicht alle onkogenen HPV-Stämme abdecken.
![]()
8. Beschränkungen
Aufgrund einer Schutzverfügung in diesem Fall ist es uns untersagt, den Inhalt der von Merck vorgelegten Dokumente zu erörtern, einschließlich der Daten aus den klinischen Versuchen von Merck, bei denen es sich um geschützte Informationen handelt.
![]()
9. Schlussfolgerungen
Die Einwilligungsformulare für die Gardasil-Impfstoffversuche von Merck scheinen in hohem Maße irreführend zu sein, da ein hoch reaktives Adjuvans mit einer fragwürdigen Sicherheitsbilanz als inaktives Placebo beschrieben wurde. Unseres Erachtens liegt somit ein Verstoß gegen das wissenschaftliche Prinzip vor, da kein echtes Placebo verwendet wurde, und ein Verstoß gegen die Ethik, da die wahre Zusammensetzung des “Placebos” nicht offengelegt wurde.
![]()
Darüber hinaus hat Merck im Widerspruch zu den Informationen im Protokoll der klinischen Studie FUTURE II zu Gardasil die potenziellen Teilnehmer darüber informiert, dass es sich bei FUTURE II nicht um eine Sicherheitsstudie handele, sondern dass der Impfstoff bereits gründlich getestet worden sei und sich als sicher erwiesen habe. Außerdem war Merck unseres Erachtens nicht transparent in Bezug auf die Zusammensetzung von AAHS, da die ersten Impfstoffe, in denen AAHS als Adjuvans verwendet wurde, in Veröffentlichungen in Fachzeitschriften und in Dokumenten, die offenbar den US-amerikanischen und europäischen Regulierungsbehörden vorgelegt wurden, als “Aluminiumhydroxid” enthaltend beschrieben wurden. In Anbetracht dieser Tatsache entbehrt jede Behauptung von Merck und den Aufsichtsbehörden, die Sicherheit von AAHS sei “gut charakterisiert”, jeder Grundlage.
![]()
Aktuelle Tier- und Humanstudien weisen darauf hin, dass Aluminiumadjuvantien mit anhaltenden und beeinträchtigenden systemischen Symptomen und neurologischen Beeinträchtigungen in Verbindung gebracht werden können.246 247 248 249 250 251 252 253 254 255 256 257 258 259 260
![]()
Es ist daher unklar, warum die Arzneimittelzulassungsbehörden weiterhin die Verwendung von “Placebos” mit Aluminiumadjuvantien in klinischen Impfstoffversuchen befürworten. Diese Praxis erschwert eine ordnungsgemäße Bewertung der Impfschäden und scheint gegen die medizinischen Ethikrichtlinien zu verstoßen, da sie die Versuchspersonen nur potenziellen Risiken aussetzt, ohne dass sie einen Nutzen davon haben.261
![]()
Danksagung
Die Autoren danken dem Rechtsanwalt Ronald Goldman für die juristische Überprüfung des Manuskripts, Anna Pedersen für die englische Übersetzung der dänischen Dokumente, Sesilje B. Petersen für die Bereitstellung der Rekrutierungs- und klinischen Studiendokumente von Merck aus der FUTURE II-Studie, Dr. Christopher Exley, Dr. Lluis Lujan, Dr. Guillemette Crépeaux, Dr. med. Rokuro Hama und Rechtsanwalt Kim Mack Rosenberg für Verbesserungsvorschläge bei der Darstellung von Sachinformationen, und vier anonyme Gutachter für ihre kritische Bewertung des Manuskripts.
![]()
Interessenkonflikt
LT und LBM werden als Forschungsberater für die Anwaltskanzlei Wisner Baum in Los Angeles in einem laufenden Gardasil-Rechtsstreit entlohnt. Robert F. Kennedy Jr., Gründer und freigestellter Vorsitzender von Children’s Health Defense (CHD), ist Co-Anwalt in diesem Rechtsstreit. LT ist ein bezahlter Forschungsberater für CHD und war bereits früher als Sachverständiger in Gerichtsverfahren tätig, bei denen es um unerwünschte Reaktionen auf Impfstoffe, einschließlich des HPV-Impfstoffs, ging. Die hierin geäußerten Ansichten sind ausschließlich die der Autoren und nicht die einer anderen Person, Firma oder Organisation. CHD und Wisner Baum haben keinen Beitrag zu diesem Artikel geleistet, abgesehen von Kim Mack Rosenberg (Rechtsanwalt und amtierender externer Rechtsberater von CHD), wie in den Danksagungen aufgeführt.
![]()
Finanzierung
Dieses Manuskript wurde nicht mit finanziellen Mitteln unterstützt.
![]()
Quellen[+]
| 1, 4, 261 | Council for International Organization of Medical Sciences (CIOMS) und Weltgesundheitsorganisation (WHO). Internationale ethische Richtlinien für biomedizinische Forschung am Menschen. Genf, Schweiz 2002 [zitiert am 2022. Oktober 17]. Verfügbar unter: https://cioms.ch/publications/product/international-ethical-guidelines-for-biomedical-research-involving-human-subjects-2 |
|---|---|
| 2 | Misra S.; Randomisierte Doppelblind-Placebo-Kontrollstudien, der “Goldstandard” bei interventionsbasierten Studien. Indian J Sex Transm Dis. (2012) ;33: (2):131-4 |
| 3, 5 | Rid A, Saxena A, Baqui AH, Bhan A, Bines J, Bouesseau MC; Placebo use in vaccine trials: Recommendations of a WHO expert panel. Vaccine. (2014) ;32: (37):4708–12 |
| 6 | Europäische Arzneimittelbehörde (EMA). Gardasil [aktualisiert am 7. Oktober 2011; zitiert am 13. März 2023]. Verfügbar unter: https://www.ema.europa.eu/en/medicines/human/EPAR/gardasil |
| 7 | Tomljenovic L, Shaw CA.; Too fast or not too fast: The FDA’s approval of Merck’s HPV vaccine Gardasil. J Law Med Ethics. (2012) ;40: (3):673–81 |
| 8, 244 | Tomljenovic L, Shaw CA.; Human papillomavirus (HPV) vaccine policy and evidence-based medicine: Are they at odds? Ann Med. (2013) ;45: (2):182–93 |
| 9, 13 | U.S. Food and Drug Administration (FDA) Center for Biologics Evaluation and Research (CBER). Clinical Review of Biologics License Application for Human Papillomavirus 6, 11, 16, 18 L1 Virus Like Particle Vaccine (S. cerevisiae) (STN 125126 GARDASIL), hergestellt von Merck Inc., 8. Juni 2006 [zitiert am 13. März 2023]. Verfügbar unter: http://wayback.archive-it.org/7993/20170723091811/https://www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM111287.pdf |
| 10, 11 | Reisinger KS, Block SL, Lazcano-Ponce E, Samakoses R, Esser MT, Erick J; Safety and persistent immunogenicity of a quadrivalent human papillomavirus types 6, 11, 16, 18 L1 virus-like particle vaccine in preadolescents and adolescents: A randomized controlled trial. Pediatr Infect Dis J. (2007) ;26: (3):201–9 |
| 12, 242 | The Future II Study Group. Quadrivalent vaccine against human papillomavirus to prevent high-grade cervical lesions. N Engl J Med. (2007) ;356: (19):1915–27 |
| 14 | Glenny AT, Pope CG, Waddington H, Wallace U.; The antigenic value of toxoid precipitated by potassium alum. J Pathol Bacteriol. (1926) ;29: :38–45 |
| 15, 22, 31, 128 | Hogenesch H.; Mechanism of immunopotentiation and safety of aluminum adjuvants. Front Immunol. (2012) ;3: :406 |
| 16, 189 | Shirodkar S, Hutchinson RL, Perry DL, White JL, Hem SL.; Aluminum compounds used as adjuvants in vaccines. Pharm Res. (1990) ;7: (12):1282–8 |
| 17 | Recombivax-Packungsbeilage. Erste US-Zulassung, S. 1 [zitiert 2023 September 8]. Verfügbar unter: https://www.fda.gov/files/vaccines%2C%20blood%20%26%20biologics/published/package-insert-recombivax-hb.pdf |
| 18, 201, 204 | National Institute of Health (NIH) National Library of Medicine (NLM). RECOMBIVAX HB (Hepatitis-B-Impfstoff – rekombinante Injektion, Suspension. Inhaltsstoffe und Aussehen [zitiert 2023 September 8]. Verfügbar unter: https://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?setid=47ef5267-5624-48d4-91e2-483e93755f6f |
| 19, 44, 190 | Caulfield MJ, Shi L, Wang S, Wang B, Tobery TW, Mach H; Effect of alternative aluminum adjuvants on the absorption and immunogenicity of HPV16 L1 VLPs in mice. Hum Vaccin. (2007) ;3: (4):139–45 |
| 20 | Ruiz W, McClements WL, Jansen KU, Esser MT.; Kinetics and isotype profile of antibody responses in rhesus macaques induced following vaccination with HPV 6, 11, 16 and 18 L1-virus-like particles formulated with or without Merck aluminum adjuvant. J Imm Based Ther Vaccines. (2005) ;3: (1):2 |
| 21 | Kjaer SK, Nygard M, Sundstrom K, Dillner J, Tryggvadottir L, Munk C; Final analysis of a 14-year long-term follow-up study of the effectiveness and immunogenicity of the quadrivalent human papillomavirus vaccine in women from four nordic countries. EClinicalMedicine. (2020) ;23: :100401 |
| 23, 39 | Zhuang CL, Lin ZJ, Bi ZF, Qiu LX, Hu FF, Liu XH; Inflammation-related adverse reactions following vaccination potentially indicate a stronger immune response. Emerg Microbes Infect. (2021) ;10: (1):365–75 |
| 24, 32, 40, 182 | Herve C, Laupeze B, Del Giudice G, Didierlaurent AM, Tavares Da Silva F.; The how’s and what’s of vaccine reactogenicity. NPJ Vaccines. (2019) ;4: :39 |
| 25 | Nakayama T, Kashiwagi Y, Kawashima H. Long-term regulation of local cytokine production following immunization in mice. Microbiol Immunol. (2018) ;62: (2):124–31 |
| 26 | Nakayama T.; An inflammatory response is essential for the development of adaptive immunity-immunogenicity and immunotoxicity. Vaccine. (2016) ;34: (47):5815–8 |
| 27, 33, 41, 61, 110, 111, 136, 144, 147, 183 | Petrovsky N.; Comparative safety of vaccine adjuvants: A summary of current evidence and future needs. Drug Saf. (2015) ;38: (11):1059–74 |
| 28, 29 | Cain DW, Sanders SE, Cunningham MM, Kelsoe G.; Disparate adjuvant properties among three formulations of “alum”. Vaccine. (2013) ;31: (4):653–60 |
| 30, 36 | Sasaki E, Furuhata K, Mizukami T, Hamaguchi I. An investigation and assessment of the muscle damage and inflammation at injection site of aluminum-adjuvanted vaccines in guinea pigs. J Toxicol Sci. (2022) ;47: (11):439–51 |
| 34 | Marichal T, Ohata K, Bedoret D, Mesnil C, Sabatel C, Kobiyama K. DNA released from dying host cells mediates aluminum adjuvant activity. Nat Med. (2011) ;17: (8):996–1002 |
| 35 | Svensson A, Sandberg T, Siesjo P, Eriksson H.; Sequestering of damage-associated molecular patterns (DAMPs): A possible mechanism affecting the immune-stimulating properties of aluminium adjuvants. Immunol Res. (2017) ;65: (6):1164–75 |
| 37, 38 | Wang XY, Yao X, Wan YM, Wang B, Xu JQ, Wen YM.; Responses to multiple injections with alum alone compared to injections with alum adsorbed to proteins in mice. Immunol Lett. (2013) ;149: (1-2):88–92 |
| 42, 43 | Petrovsky N. Vaccine adjuvant safety: The elephant in the room. Expert Rev Vaccines. (2013) ;12: (7):715–7 |
| 45 | Gardasil-Packungsbeilage [zitiert 2023 März 13]. Verfügbar unter: https://www.fda.gov/media/74350/download?attachment |
| 46, 80, 112, 246 | Masson JD, Angrand L, Badran G, de Miguel R, Crépeaux G.; Clearance, biodistribution, and neuromodulatory effects of aluminum-based adjuvants. Systematic review and meta-analysis: What do we learn from animal studies? Crit Rev Toxicol. (2022) ;52: (6):403–19 |
| 47, 81, 94, 108, 109, 113, 247 | Varela-Martinez E, Bilbao-Arribas M, Abendano N, Asin J, Perez M, de Andres D; Whole transcriptome approach to evaluate the effect of aluminium hydroxide in ovine encephalon. Sci Rep. (2020) ;10: (1):15240 |
| 48, 82, 95, 107, 248 | Asin J, Pascual-Alonso M, Pinczowski P, Gimeno M, Perez M, Muniesa A; Cognition and behavior in sheep repetitively inoculated with aluminum adjuvant-containing vaccines or aluminum adjuvant only. J Inorg Biochem. (2020) ;203: :110934 |
| 49, 83, 96 | Bruce M, Streifel KM, Boosalis CA, Heuer L, Gonzalez EA, Li S; Acute peripheral immune activation alters cytokine expression and glial activation in the early postnatal rat brain. J Neuroinflammation. (2019) ;16: (1):200 |
| 50, 84, 97, 249 | Sheth SKS, Li Y, Shaw AC.; Is exposure to aluminium adjuvants associated with social impairments in mice? A pilot study. J Inorg Biochem. (2018) ;181: :96–103 |
| 51, 85, 98, 114, 250 | Crépeaux G, Eidi H, David MO, Baba-Amer Y, Tzavara E, Giros B; Non-linear dose-response of aluminium hydroxide adjuvant particles: Selective low dose neurotoxicity. Toxicology. (2017) ;375: :48–57 |
| 52, 86, 99, 251 | Kivity S, Arango MT, Molano-Gonzalez N, Blank M, Shoenfeld Y.; Phospholipid supplementation can attenuate vaccine-induced depressive-like behavior in mice. Immunol Res. (2017) ;65: (1):99–105 |
| 53, 87, 100, 252 | Inbar R, Weiss R, Tomljenovic L, Arango MT, Deri Y, Shaw CA; Behavioral abnormalities in female mice following administration of aluminum adjuvants and the human papillomavirus (HPV) vaccine Gardasil. Immunol Res. (2017) ;65: (1):136–49 |
| 54, 88 | Agmon-Levin N, Arango MT, Kivity S, Katzav A, Gilburd B, Blank M; Immunization with hepatitis B vaccine accelerates SLE-like disease in a murine model. J Autoimmun. (2014) ;54: :21–32 |
| 55, 115 | Khan Z, Combadiere C, Authier FJ, Itier V, Lux F, Exley C; Slow CCL2-dependent translocation of biopersistent particles from muscle to brain. BMC Med. (2013) ;11: :99 |
| 56, 89, 101, 253 | Shaw CA, Li Y, Tomljenovic L.; Administration of aluminium in vaccine-relevant amounts in neonatal mice is associated with long-term adverse neurological outcomes. J Inorg Biochem. (2013) ;128: :237–44 |
| 57, 90, 102, 116, 254 | Shaw CA, Petrik MS.; Aluminum hydroxide injections lead to motor deficits and motor neuron degeneration. J Inorg Biochem. (2009) ;103: (11):1555–62 |
| 58, 91, 103, 117, 255 | Petrik MS, Wong MC, Tabata RC, Garry RF, Shaw CA.; Aluminum adjuvant linked to Gulf War illness induces motor neuron death in mice. Neuromolecular Med. (2007) ;9: (1):83–100 |
| 59, 60 | Regnström K, Ragnarsson EG, Rydell N, Sjoholm I, Artursson P.; Tetanus antigen modulates the gene expression profile of aluminum phosphate adjuvant in spleen lymphocytes in vivo. Pharmacogenomics J. (2002) ;2: (1):57–64 |
| 62, 118, 158, 256 | Gherardi RK, Crépeaux G, Authier FJ.; Myalgia and chronic fatigue syndrome following immunization: Macrophagic myofasciitis and animal studies support linkage to aluminum adjuvant persistency and diffusion in the immune system. Autoimmun Rev. (2019) ;18: (7):691–705 |
| 63, 257 | Passeri E, Villa C, Couette M, Itti E, Brugieres P, Cesaro P; Long-term follow-up of cognitive dysfunction in patients with aluminum hydroxide-induced macrophagic myofasciitis (MMF). J Inorg Biochem. (2011) ;105: (11):1457–63 |
| 64 | Kim H, Lim KY, Kang J, Park JW, Park SH. Macrophagic myofasciitis and subcutaneous pseudolymphoma caused by aluminium adjuvants. Scientific Reports. (2020) ;10: (1):11834 |
| 65 | Gøtzsche PC, Jørgensen KJ.; EMA’s mishandling of an investigation into suspected serious neurological harms of HPV vaccines. BMJ Evid Based Med. (2022) ;27: (1):7–10 |
| 66 | Zhang L, Ihsan AU, Cao Y, Cheng Y, Zhou X. Establishment of experimental autoimmune prostatitis model by T(2) peptide in aluminium hydroxide adjuvant. Andrologia. (2018) ;50: (3) |
| 67 | Khan FU, Ihsan AU, Nawaz W, Khan MZ, Yang M, Wang G; A novel mouse model of chronic prostatitis/chronic pelvic pain syndrome induced by immunization of special peptide fragment with aluminum hydroxide adjuvant. Immunol Lett. (2017) ;187: :61–7 |
| 68 | Zhu H, Chen Y, Zhou Y, Wang Y, Zheng J, Pan M.; Cognate Th2-B cell interaction is essential for the autoantibody production in pemphigus vulgaris. J Clin Immunol. (2012) ;32: (1):114–23 |
| 69 | Gounni AS, Spanel-Borowski K, Palacios M, Heusser C, Moncada S, Lobos E.; Pulmonary inflammation induced by a recombinant Brugia malayi gamma-glutamyl transpeptidase homolog: Involvement of humoral autoimmune responses. Mol Med. (2001) ;7: (5):344–54 |
| 70, 71, 72, 75, 76, 152, 180, 230 | Doshi P, Bourgeois F, Hong K, Jones M, Lee H, Shamseer L; Adjuvant-containing control arms in pivotal quadrivalent human papillomavirus vaccine trials: Restoration of previously unpublished methodology. BMJ Evid Based Med. (2020) ;25: (6):213–9 |
| 73 | U.S. Food and Drug Administration (FDA) Center for Biologics Evaluation and Research (CBER). Clinical Review of Biologics License Application for Human Papillomavirus 6, 11, 16, 18 L1 Virus Like Particle Vaccine (S. cerevisiae) (STN 125126 GARDASIL), hergestellt von Merck, Inc., 8. Juni 2006 [zitiert am 13. März 2023]. Verfügbar unter: http://wayback.archive-it.org/7993/20170723091811/https://www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM111287.pdf |
| 74 | Garland SM, Cheung TH, McNeill S, Petersen LK, Romaguera J, Vazquez-Narvaez J; Safety and immunogenicity of a 9-valent HPV vaccine in females 12–26 years of age who previously received the quadrivalent HPV vaccine. Vaccine. (2015) ;33: (48):6855–64 |
| 77, 129, 148 | Eickhoff TC, Myers M.; Workshop summary. Aluminum in vaccines. Vaccine. (2002) ;20: (Suppl 3):S1–4 |
| 78, 149, 188, 191, 207, 221, 224, 227 | Petersen SB, Gluud C.; Was amorphous aluminium hydroxyphosphate sulfate adequately evaluated before authorisation in Europe? BMJ Evid Based Med [Supplementary Material]. (2021) ;26: (6):285–9 |
| 79, 137, 150, 203, 208 | Baylor NW, Egan W, Richman P.; Aluminum salts in vaccines–US perspective. Vaccine. (2002) ;20: (Suppl 3):S18–23 |
| 92, 104 | Eidi H, Yoo J, Bairwa SC, Kuo M, Sayre EC, Tomljenovic L; Early postnatal injections of whole vaccines compared to placebo controls: Differential behavioural outcomes in mice. J Inorg Biochem. (2020) ;212: :111200 |
| 93, 105, 119, 259 | Lujan L, Perez M, Salazar E, Alvarez N, Gimeno M, Pinczowski P; Autoimmune/autoinflammatory syndrome induced by adjuvants (ASIA syndrome) in commercial sheep. Immunol Res. (2013) ;56: (2-3):317–24 |
| 106, 120 | de Miguel R, Asin J, Rodriguez-Largo A, Molin J, Echeverria I, de Andres D; Detection of aluminum in lumbar spinal cord of sheep subcutaneously inoculated with aluminum-hydroxide containing products. J Inorg Biochem. (2020) ;204: :110871 |
| 121 | Asin J, Molin J, Perez M, Pinczowski P, Gimeno M, Navascues N; Granulomas following subcutaneous injection with aluminum adjuvant-containing products in sheep. Vet Pathol. (2019) ;56: (3):418–28 |
| 122 | Crépeaux G, Authier FJ, Exley C, Lujan L, Gherardi RK.; The role of aluminum adjuvants in vaccines raises issues that deserve independent, rigorous and honest science. J Trace Elem Med Biol. (2020) ;62: :126632 |
| 123 | Masson JD, Crépeaux G, Authier FJ, Exley C, Gherardi RK.; Critical analysis of reference studies on the toxicokinetics of aluminum-based adjuvants. J Inorg Biochem. (2018) ;181: :87–95 |
| 124, 260 | Gherardi RK, Eidi H, Crépeaux G, Authier FJ, Cadusseau J.; Biopersistence and brain translocation of aluminum adjuvants of vaccines. Front Neurol. (2015) ;6: :4 |
| 125 | Eidi H, David MO, Crépeaux G, Henry L, Joshi V, Berger MH; Fluorescent nanodiamonds as a relevant tag for the assessment of alum adjuvant particle biodisposition. BMC Med. (2015) ;13: :144 |
| 126 | Globaler Beratender Ausschuss für die Sicherheit von Impfstoffen, 2. bis 3. Dezember 2004. Sicherheit von Adjuvantien. Weekly Epi Rec. 2005;80(1):3-7 [zitiert 2023 März 13]. Verfügbar unter: https://apps.who.int/iris/bitstream/handle/10665/232676/WER8001_3-7.PDF?sequence=1&isAllowed=y |
| 127, 145, 234, 235 | Globaler Beratender Ausschuss für die Sicherheit von Impfstoffen, 10.-11. Juni 2004. Sicherheit von Adjuvantien. Weekly Epi Rec. 2004;79(29):265-72 [zitiert 2023 März 13]. Verfügbar unter: https://cdn.who.int/media/docs/default-source/a-future-for-children/wer7929_2004_vol79-29.pdf?sfvrsn=b1fd77c5_1&download=true |
| 130 | Shardlow E, Mold M, Exley C.; Unraveling the enigma: Elucidating the relationship between the physicochemical properties of aluminium-based adjuvants and their immunological mechanisms of action. Allergy Asthma Clin Immunol. (2018) ;14: :80 |
| 131 | Mold M, Shardlow E, Exley C.; Insight into the cellular fate and toxicity of aluminium adjuvants used in clinically approved human vaccinations. Sci Reports. (2016) ;6: :31578 |
| 132, 141, 146, 211, 223, 231, 233 | Mastelic B, Garcon N, Del Giudice G, Golding H, Gruber M, Neels P; Predictive markers of safety and immunogenicity of adjuvanted vaccines. Biologicals. (2013) ;41: (6):458–68 |
| 133, 135 | Pelka K, Latz E.; Getting closer to the dirty little secret. Immunity. (2011) ;34: (4):455–58 |
| 134 | Janeway CA Jr.; Approaching the asymptote? Evolution and revolution in immunology. Cold Spring Harbor Symposia on Quantitative Biology. (1989) ;54: (Pt 1):1–13 |
| 138, 140 | U.S. Department of Health and Human Services (DHHS), Food and Drug Administration (FDA), Workshop on Non-clinical Safety Evaluation of Preventative Vaccines: Recent Advances and Regulatory Considerations. Bd. I, 2. Dezember 2002. Arlington, Virginia. S. 11 [der ursprüngliche Link ist nicht mehr gültig, aber das PDF des Dokuments kann per E-Mail an den entsprechenden Autor angefordert werden] |
| 139, 236 | Der Ausschuss für Humanarzneimittel (CHMP) der Europäischen Arzneimittel-Agentur (EMA): Guideline on adjuvants in vaccines for human use. 2005 [zitiert 2023 März 13]. Verfügbar unter: https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-adjuvants-vaccines-human-use-see-also-explanatory-note_en.pdf |
| 142 | Weltgesundheitsorganisation (WHO). WHO-Leitlinien zur nicht-klinischen Bewertung von Impfstoffen. Anhang 1. WHO Technical Report Series, Nr. 927, 2005 [zitiert 2023 März 13]. Verfügbar unter: https://www.who.int/publications/m/item/TRS-987-annex2 |
| 143 | Van der Laan JW, Forster R, Ledwith B, Gruber M, Gold S, Segal L; Nonclinical testing of vaccines: Report from a workshop. Drug Inform J. (2009) ;43: (1):97–107 |
| 151, 153, 154, 155 | Petersen SB, Gluud C.; Was amorphous aluminium hydroxyphosphate sulfate adequately evaluated before authorisation in Europe? BMJ Evid Based Med. (2021) ;26: (6):285–9 |
| 156 | Sorensen T, Andersen PT.; A qualitative study of women who experience side effects from human papillomavirus vaccination. Dan Med J. (2016) ;63(: (12) |
| 157, 159 | Bericht der dänischen Gesundheits- und Arzneimittelbehörde zur Prüfung durch die EMA und die Berichterstatter in Bezug auf die Bewertung des Sicherheitsprofils von HPV-Impfstoffen. 04.09.2015 [zitiert am 26. November 2023]. Verfügbar unter: https://laegemiddelstyrelsen.dk/∼/media/0A404AD71555435BB311CD59CB63071A.ashx |
| 160 | Mehlsen J, Brinth L, Pors K, Varming K, Wallukat G, Olsen RKJ.; Autoimmunity in patients reporting long-term complications after exposure to human papilloma virus vaccination. J Autoimmun. (2022) ;133: :102921 |
| 161 | Hineno A, Ikeda SI.; A long-term observation on the possible adverse effects in japanese adolescent girls after human papillomavirus vaccination. Vaccines. (2021) ;9: (8) |
| 162 | Martinez-Lavin M, Tejada-Ruiz M.; Gulf war illness, post-HPV vaccination syndrome, and macrophagic myofasciitis. Similar disabling conditions possibly linked to vaccine-induced autoimmune dysautonomia. Autoimmun Rev. (2020) ;19: (9):102603 |
| 163 | Ryabkova VA, Churilov LP, Shoenfeld Y.; Neuroimmunology: What role for autoimmunity, neuroinflammation, and small fiber neuropathy in fibromyalgia, chronic fatigue syndrome, and adverse events after human papillomavirus vaccination? Int J Mol Sci. (2019) ;20: (20):5164 |
| 164 | Ikeda SI, Hineno A, Ozawa K, Kinoshita T.; Suspected adverse effects after human papillomavirus vaccination: a temporal relationship. Immunol Res. (2018) ;66: (6):723–5 |
| 165 | Blitshteyn S, Brinth L, Hendrickson JE, Martinez-Lavin M.; Autonomic dysfunction and HPV immunization: An overview. Immunol Res. (2018) ;66: (6):744–54 |
| 166 | Beppu H, Minaguchi M, Uchide K, Kumamoto K, Sekiguchi M, Yaju Y.; Lessons learnt in Japan from adverse reactions to the HPV vaccine: A medical ethics perspective. Indian Journal of Medical Ethics. (2017) ;2: (2):82–8 |
| 167 | Chandler RE, Juhlin K, Fransson J, Caster O, Edwards IR, Noren GN.; Current safety concerns with human papillomavirus vaccine: A cluster analysis of reports in vigiBase (R). Drug Saf. (2017) ;40: (1):81–90 |
| 168 | Chandler RE.; Safety concerns with HPV vaccines continue to linger: Are current vaccine pharmacovigilance practices sufficient? Drug Saf. (2017) ;40: (12):1167–70 |
| 169 | Palmieri B, Poddighe D, Vadala M, Laurino C, Carnovale C, Clementi E.; Severe somatoform and dysautonomic syndromes after HPV vaccination: Case series and review of literature. Immunol Res. (2017) ;65: (1):106–16 |
| 170 | Brinth LS, Pors K, Theibel AC, Mehlsen J.; Orthostatic intolerance and postural tachycardia syndrome as suspected adverse effects of vaccination against human papilloma virus. Vaccine. (2015) ;33: (22):2602–5 |
| 171 | Brinth L, Pors K, Alexandra A, Hoppe G, Badreldin I, Mehlsen J.; Is chronic fatigue syndrome/myalgic encephalomyelitis a relevant diagnosis in patients with suspected side effects to human papilloma virus vaccine? Int J Vaccines Vaccin. (2015) ;1: (1):9–12 |
| 172 | Kinoshita T, Abe RT, Hineno A, Tsunekawa K, Nakane S, Ikeda S.; Peripheral sympathetic nerve dysfunction in adolescent Japanese girls following immunization with the human papillomavirus vaccine. Intern Med. (2014) ;53: (19):2185–200 |
| 173 | Blitshteyn S.; Postural tachycardia syndrome following human papillomavirus vaccination. Eur J Neurol. (2014) ;21: (1):135–9 |
| 174 | Nishioka K, Yokota S, Matsumoto Y.; Clinical features and preliminary diagnostic criteria of human papillomavirus vaccination associated with neuroimmunopathic syndrome (HANS). Int J Rheum Dis. (2014) ;17: (suppl 2):6 |
| 175 | Kanduc D, Shoenfeld Y.; Human papillomavirus epitope mimicry and autoimmunity: the molecular truth of peptide sharing. Pathobiology. (2019) ;86: (5–6):285–95 |
| 176 | Segal Y, Dahan S, Calabro M, Kanduc D, Shoenfeld Y.; HPV and systemic lupus erythematosus: A mosaic of potential crossreactions. Immunol Res. (2017) ;65: (2):564–71 |
| 177 | Kanduc D.; Potential cross-reactivity between HPV16 L1 protein and sudden death-associated antigens. J Exp Ther Oncol. (2011) ;9(: (2):159–65 |
| 178 | Kanduc D.; Quantifying the possible cross-reactivity risk of an HPV16 vaccine. J Exp Ther Oncol. (2009) ;8: (1):65–76 |
| 179, 184, 228 | Europäische Arzneimittel-Agentur. Stellvertretender Verwaltungsdirektor Noel Wathion. Antwort auf das Beschwerdeschreiben von Peter Gøtzsche und Nordic Cochrane vom 26. Mai 2016 über den Missstand in der Verwaltungstätigkeit der EMA. 1. Juli 2016 [zitiert am 7. Mai 2023]. Verfügbar unter: https://www.ema.europa.eu/en/documents/other/ema-response-nordic-cochrane-letter-ema-response-nordic-cochrane-letter-human-papillomavirus-hpv_en.pdf |
| 181, 185 | Nordic Cochrane Centre. Bewertung der Entscheidung des Europäischen Ombudsmannes. 2. November 2017 [zitiert am 7. Mai 2023]. Verfügbar unter: https://www.deadlymedicines.dk/wp-content/uploads/2019/02/1.-2017-11-02-Our-assessment-on-the-Ombudsmans-decision.pdf |
| 186 | Nordic Cochrane Centre. Beschwerde beim Europäischen Ombudsmann über Missstände bei der Europäischen Arzneimittel-Agentur (EMA) in Bezug auf die Sicherheit der HPV-Impfstoffe. 10. Oktober 2016 [zitiert am 7. Mai 2023]. Verfügbar unter: https://www.deadlymedicines.dk/wp-content/uploads/2019/02/8.-2016-10-10-Complaint-to-the-EU-ombudsman-over-the-EMA.pdf |
| 187 | MSD-Handbuch Professionelle Version. Medizinische Themen & Kapitel. Klinische Pharmakologie. Konzepte der Pharmakotherapie: Placebos. Ethische Erwägungen [aktualisiert im September 2022; zitiert am 7. Mai 2023]. Verfügbar unter: https://www.msdmanuals.com/professional/clinical-pharmacology/concepts-in-pharmacotherapy/placebos |
| 192 | Procomvax. Zusammenfassung der Produktmerkmale. 6.1 Liste der Hilfsstoffe, S. 8. 1999 [zitiert am 8. September 2023]. Verfügbar unter: https://ec.europa.eu/health/documents/community-register/1999/199905073308/anx_3308_en.pdf |
| 193 | Procomvax. Zusammenfassung der Produktmerkmale. 6.1 Liste der Hilfsstoffe, S. 7. 2004 [zitiert am 8. September 2023]. Verfügbar unter: https://ec.europa.eu/health/documents/community-register/2004/200408027917/anx_7917_en.pdf |
| 194 | Comvax-Impfstoff Verschreibungsinformationen. Packungsbeilage. Beschreibung [zitiert am 8. September 2023]. Verfügbar unter: https://www.drugs.com/pro/comvax-vaccine.html |
| 195 | Pedvax HIB flüssig. Packungsbeilage. Beschreibung [zitiert am 8. September 2023]. Verfügbar unter: https://www.fda.gov/media/80438/download |
| 196 | U.S. Centers for Disease Control and Prevention (CDC). Mitteilungen an die Leser. Zulassung eines Hämophilus-B-Konjugatimpfstoffs für Säuglinge durch die Food and Drug Administration. MMWR. (1990) ;39: (50):925. [zitiert am 8. September 2023]. Verfügbar unter: https://www.cdc.gov/mmwr/preview/mmwrhtml/00001866.htm |
| 197, 210, 213 | Santosham M, Wolff M, Reid R, Hohenboken M, Bateman M, Goepp J; The efficacy in Navajo infants of a conjugate vaccine consisting of Haemophilus influenzae type b polysaccharide and Neisseria meningitidis outer-membrane protein complex. N Engl J Med. (1991) ;324: (25):1767–72 |
| 198, 205 | Recombivax-Packungsbeilage. 11 Beschreibung, S. 7 [zitiert am 8. September 2023]. Verfügbar unter: https://www.fda.gov/files/vaccines%2C%20blood%20%26%20biologics/published/package-insert-recombivax-hb.pdf |
| 199 | Recombivax HB . Zusammenfassung der Zulassungsgrundlage. 1987 [zitiert am 8. September 2023]. Verfügbar unter: https://wayback.archive-it.org/7993/20170723025131/https://www.fda.gov/downloads/BiologicsBloodVaccines/Vaccines/ApprovedProducts/UCM244544.pdf |
| 200 | U.S. Centers for Disease Control and Prevention (CDC). Recommendations of the immunization practices Advisory Committee (ACIP) update on hepatitis B prevention. MMWR. (1987) ;26: (23):353–66 |
| 202, 206 | National Institute of Health (NIH) National Center for Advancing Translational Sciences. Inxight-Medikamente. Aluminiumhydroxyphosphat-Sulfat [zitiert am 8. September 2023]. Verfügbar unter: https://drugs.ncats.io/drug/F41V936QZM#identifiers |
| 209 | Recombivax-Packungsbeilage. 6 Unerwünschte Wirkungen, S. 6 [zitiert am 8. September 2023]. Verfügbar unter: https://www.fda.gov/files/vaccines%2C%20blood%20%26%20biologics/published/package-insert-recombivax-hb.pdf |
| 212 | Agmon-Levin N, Paz Z, Israeli E, Shoenfeld Y; Vaccines and autoimmunity. Nat Rev Rheumatol. (2009) ;5: (11):648–52 |
| 214, 217, 219 | Werzberger A, Mensch B, Kuter B, Brown L, Lewis J, Sitrin R; A controlled trial of a formalin-inactivated hepatitis A vaccine in healthy children. N Engl J Med. (1992) ;327: (7):453–7 |
| 215, 218, 220 | Vaqta-Packungsbeilage. Verfügbar unter: https://www.fda.gov/media/74519/download |
| 216 | Werzberger A, Kuter B, Shouval D, Mensch B, Brown L, Wiens B; Anatomy of a trial: A historical view of the Monroe inactivated hepatitis A protective efficacy trial. J Hepatol. (1993) ;18: (Suppl 2):S46–50 |
| 222 | Weltgesundheitsorganisation (WHO). WHO-Leitlinien zur nicht-klinischen Bewertung von Impfstoff-Adjuvantien und adjuvantierten Impfstoffen. Annex 2. WHO Technical Report Series No. 987, 2014 [zitiert am 7. Mai 2023]. Verfügbar unter: https://cdn.who.int/media/docs/default-source/biologicals/vaccine-standardization/trs_987_annex2.pdf?sfvrsn=ea91caca_3&download=true |
| 225, 229 | Europäische Arzneimittel-Agentur (EMA) Ausschuss für Humanarzneimittel (CHMP). Bewertungsbericht, Gardasil 9. 2.2.12 Diskussion über nichtklinische Aspekte. 26. März 2015, EMA/CHMP/76591/2015 [zitiert am 7. Mai 2023]. Verfügbar unter: https://www.ema.europa.eu/en/documents/assessment-report/gardasil-9-epar-public-assessment-report_en.pdf |
| 226 | Gardasil-Packungsbeilage [zitiert am 13. März 2023]. Verfügbar unter: https://www.fda.gov/media/74350/download?attachment |
| 232 | Gruber MF, Marshall VB.; Regulation and testing of vaccines. In: Plotkin SA, Orenstein WA, Offit PA, Edwards KM, editors. Plotkin’s Vaccines. Elsevier; 2018. S. 1547–65 |
| 237, 238, 239 | Jørgensen L, Gøtzsche PC, Jefferson T.; Benefits and harms of the human papillomavirus (HPV) vaccines: Systematic review with meta-analyses of trial data from clinical study reports. Syst Rev. (2020) ;9: (1):43 |
| 240, 245 | Lei J, Ploner A, Elfstrom KM, Wang J, Roth A, Fang F; HPV vaccination and the risk of invasive cervical cancer. N Engl J Med. (2020) ;383: (14):1340–8 |
| 241 | National Institute of Health (NIH). Nationales Krebsinstitut (NCI). Große Studie bestätigt, dass HPV-Impfstoff Gebärmutterhalskrebs vorbeugt. 14. Oktober 2020 [zitiert am 8. September 2023]. Verfügbar unter: https://www.cancer.gov/news-events/cancer-currents-blog/2020/hpv-vaccine-prevents-cervical-cancer-sweden-study |
| 243 | U.S. Centers for Disease Control and Prevention (CDC). HPV Vaccine Safety and Effectiveness [zitiert am 8. September 2023]. Verfügbar unter: https://www.cdc.gov/vaccines/vpd/hpv/hcp/safety-effectiveness.html |
| 258 | Kim H, Lim KY, Kang J, Park JW, Park SH.; Macrophagic myofasciitis and subcutaneous pseudolymphoma caused by aluminium adjuvants. Scientific Reports. (2020) ;10: (1):11834 |
Am 31.05.24 erschienen auf: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC11191454/
![]()


 Spendier mir 'nen Kaffee
Spendier mir 'nen Kaffee